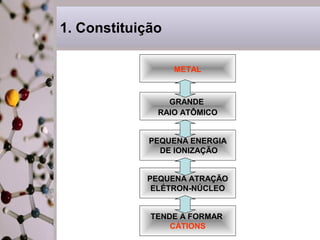
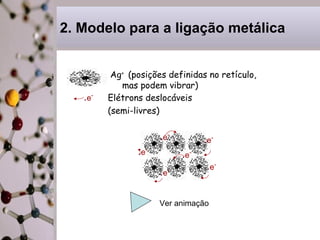
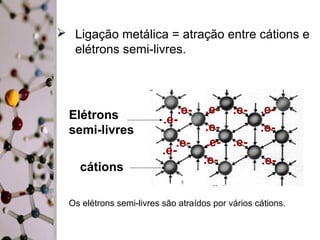
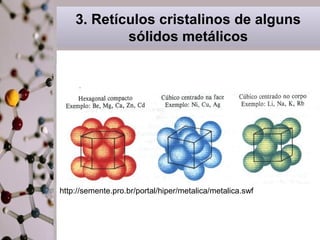
Este documento discute a ligação metálica em metais. Explica que a ligação metálica resulta da atração entre cátions metálicos e elétrons semi-livres. Discute também que as propriedades dos metais como boa condutividade elétrica e térmica e maleabilidade estão relacionadas à mobilidade destes elétrons semi-livres. Finalmente, contrasta as propriedades dos sólidos metálicos com as dos sólidos iônicos.