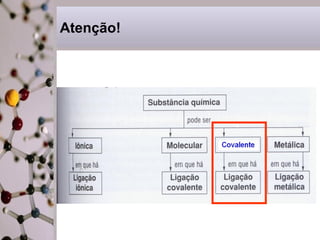
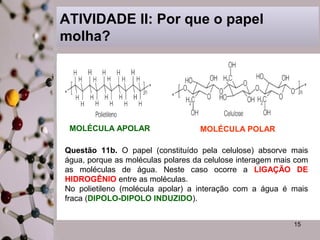
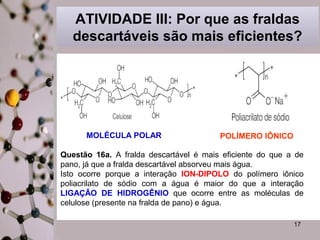
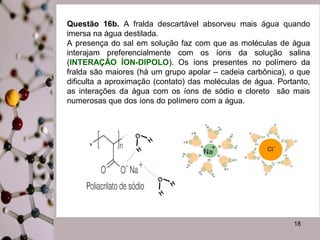
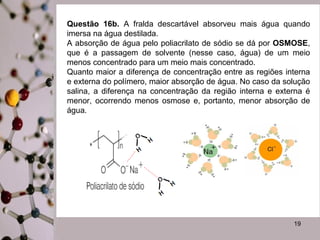
Este documento discute substâncias covalentes e polímeros. Apresenta exemplos de polímeros como silício e oxigênio. Também descreve atividades sobre como cristais de gel funcionam para plantas, por que o papel molha, e por que fraldas descartáveis são mais eficientes do que fraldas de pano.