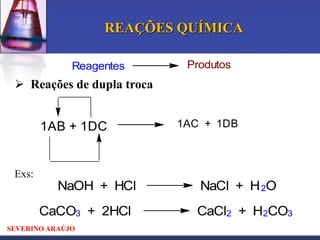
O documento discute reações químicas e estequiometria. Ele apresenta os seguintes tópicos:
1) Tipos de reações químicas como adição, decomposição, troca simples e dupla.
2) Cálculos estequiométricos fundamentais como massa atômica, molecular, proporções entre reagentes e produtos.
3) Exemplos de exercícios sobre tipos de reações e cálculos estequiométricos.