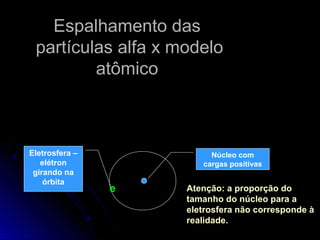
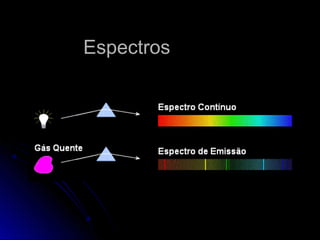
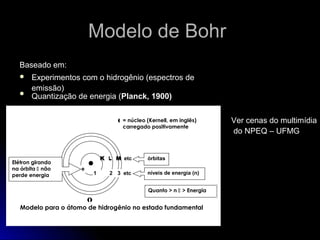
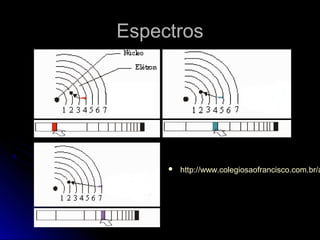
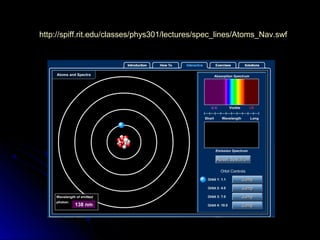
O documento discute os modelos atômicos de Thomson, Rutherford e Bohr, que tentaram explicar os resultados do espalhamento de partículas alfa e os espectros de emissão. O modelo de Bohr, de 1913, propôs que os elétrons orbitam o núcleo em órbitas quantizadas, explicando os espectros de linhas do hidrogênio. No entanto, o modelo de Bohr ainda tinha limitações e foi posteriormente criticado.