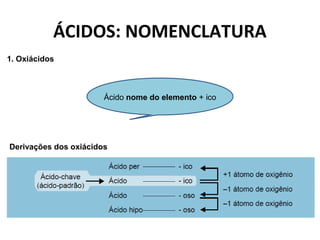
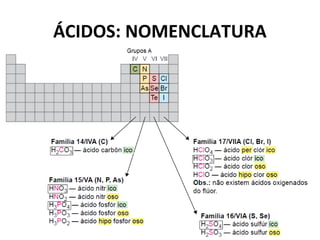
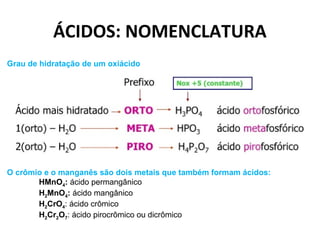
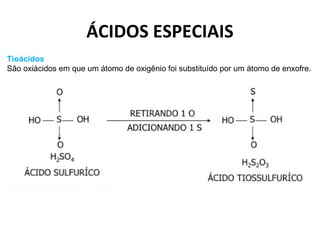
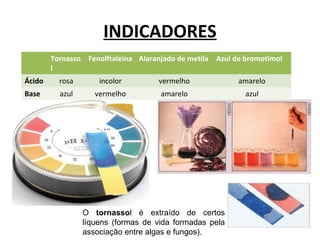
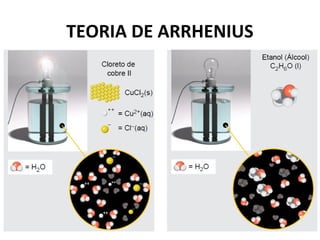
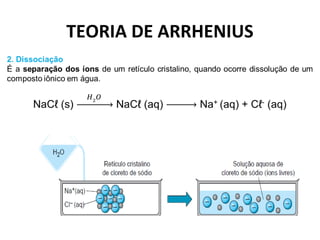
O documento discute a teoria de Arrhenius e classifica e nomeia ácidos, bases, sais e óxidos. Trata da definição e classificação de ácidos, bases e sais de acordo com sua composição química e propriedades. Também aborda indicadores de pH e os diferentes tipos de óxidos de acordo com sua reatividade.




![ÁCIDOS: DEFINIÇÃO E CLASSIFICAÇÃO
Classificação
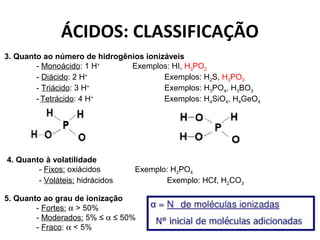
1.Quanto à presença de oxigênio
- Hidrácidos: não têm oxigênio Exemplos: HI, HBr, HCN
- Oxiácidos: têm oxigênio Exemplos: H2CO3, H2SO4
2. Quanto ao número de elementos químicos
- Binário: 2 elementos Exemplo: HI
- Ternário: 3 elementos Exemplo: HCℓO
- Quaternário: 4 elementos Exemplo: H4[Fe(CN)6]
Obs.: H4[Fe(CN)6] = Ácido ferrocianídrico (íon Fe2+) ou ferrocianeto de hidrogênio
H3[Fe(CN)6] = Ácido ferricianídrico (íon Fe3+)](https://image.slidesharecdn.com/a5ifuncoesinorganicas-141026201634-conversion-gate02/85/A5-i-funcoes_inorganicas-7-320.jpg)