Este documento contém:
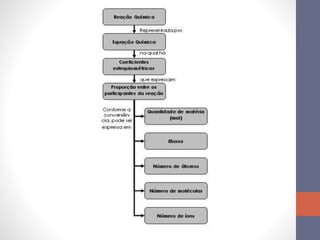
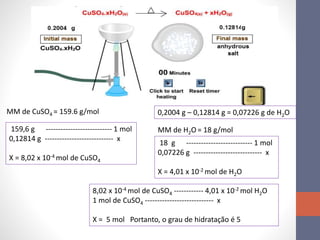
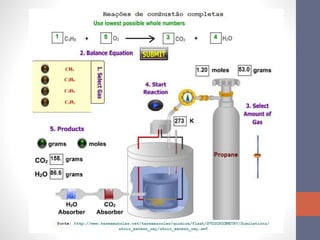
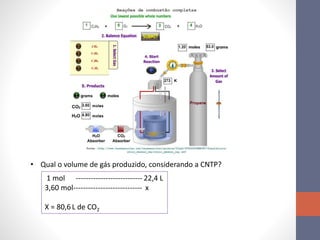
1. Uma atividade laboratorial sobre cálculos estequiométricos e determinação de grau de hidratação de sais.
2. Três questões resolvidas sobre composição de sais hidratados e cálculos envolvendo reações químicas.
3. Links para simulações online sobre reagente limitante, combustão e equações estequiométricas.