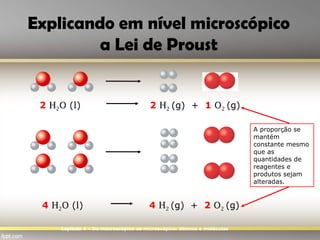
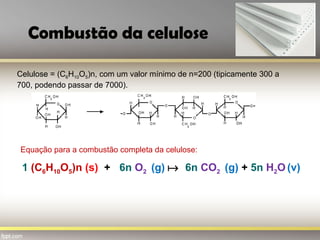
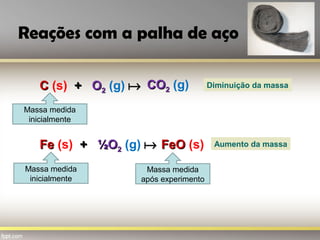
O documento discute as leis ponderais da química, incluindo a lei da conservação da massa e a lei das proporções constantes. A lei da conservação da massa estabelece que a massa total de reagentes é igual à massa total de produtos em uma reação química. A lei das proporções constantes afirma que a composição química de substâncias compostas é sempre constante, independentemente de suas origens. O documento fornece exemplos dessas leis usando reações químicas com papel,