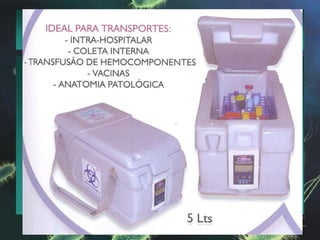
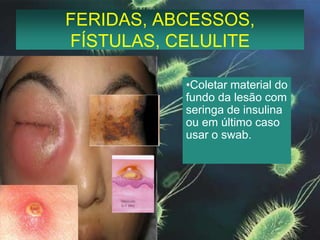
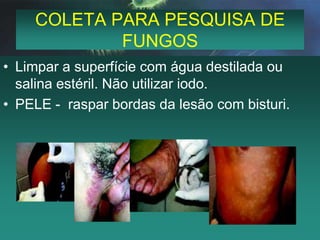
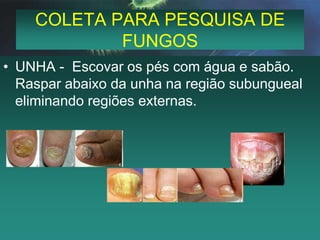
Este documento fornece instruções detalhadas sobre a coleta, transporte e conservação de amostras em microbiologia. Ele descreve os procedimentos corretos para diferentes tipos de amostras, incluindo feridas, escarros, hemoculturas e amostras de pele e unhas para pesquisa de fungos. O documento enfatiza a importância de se seguir as técnicas adequadas para garantir a qualidade da amostra e resultados precisos dos exames.