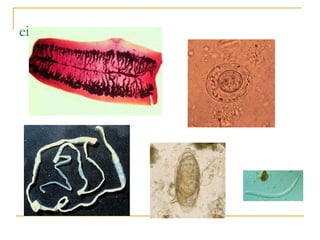
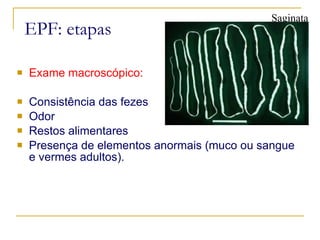
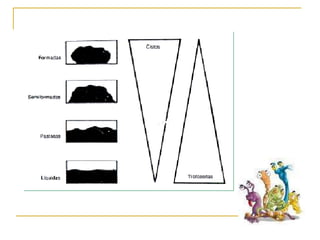
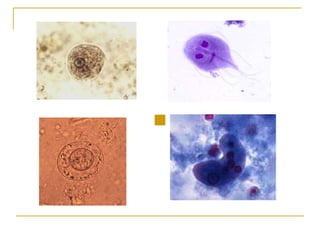
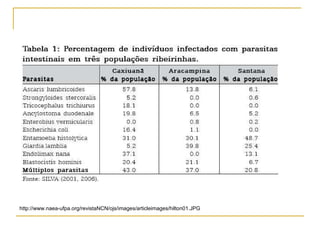
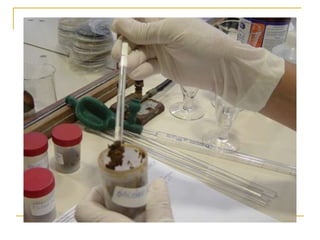
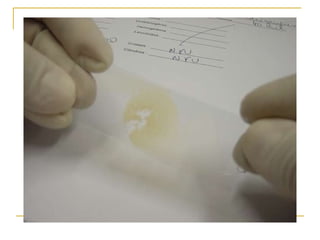
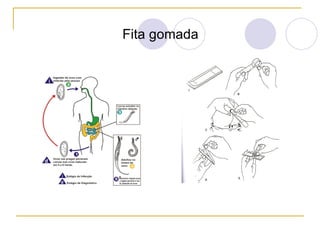
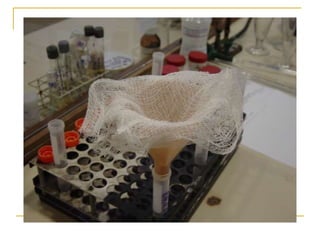
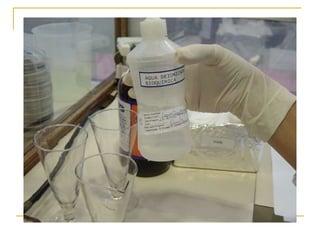
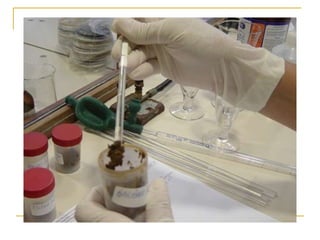
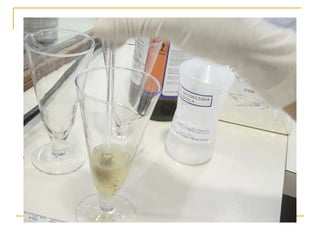
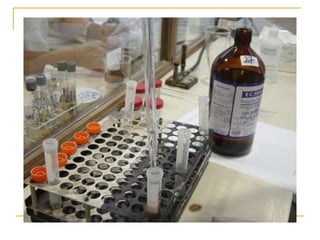
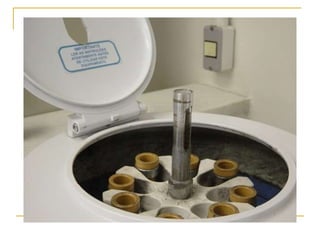
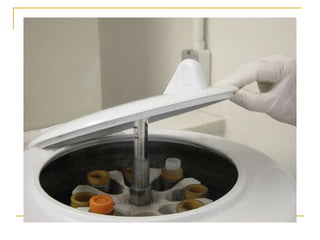
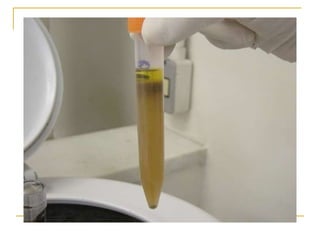
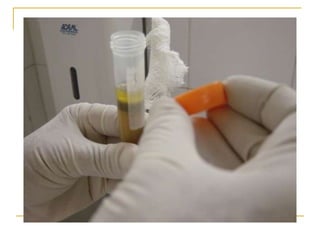
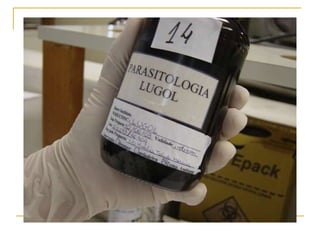
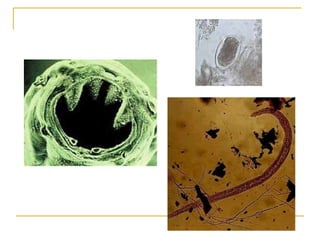
O documento descreve os procedimentos para realização do exame parasitológico de fezes (EPF), incluindo coleta de amostras, técnicas de análise como fresco, sedimentação, concentração e identificação de ovos, larvas e protozoários. Detalha também armazenamento das amostras, indicações clínicas para o exame e redação do laudo.