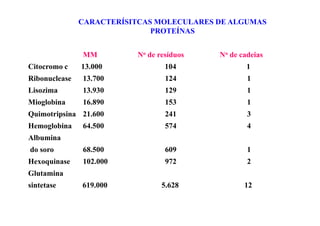
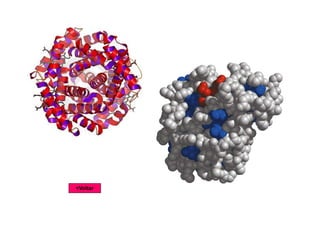
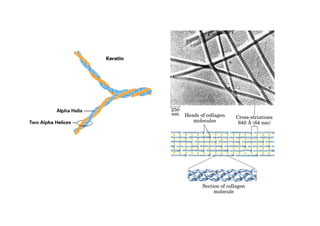
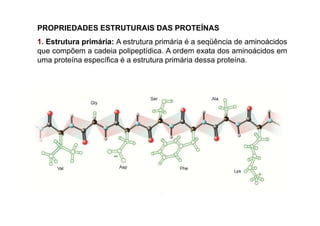
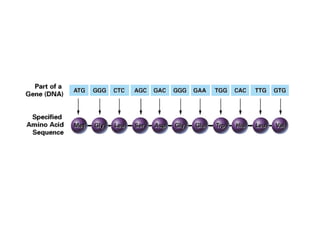
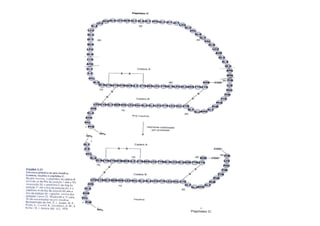
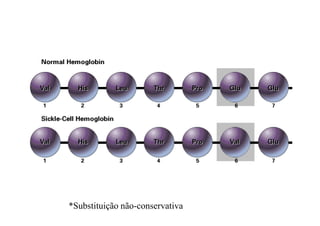
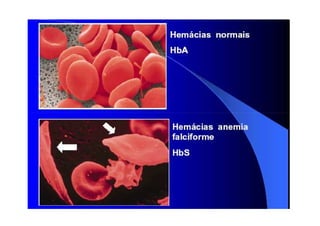
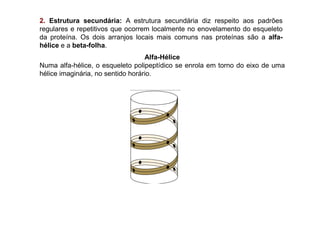
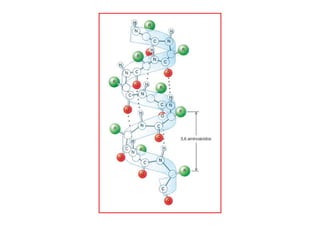
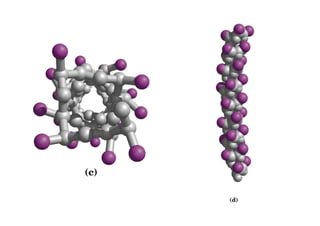
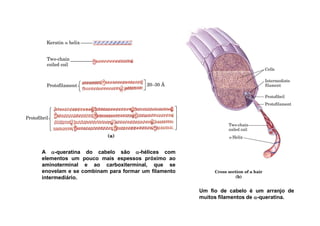
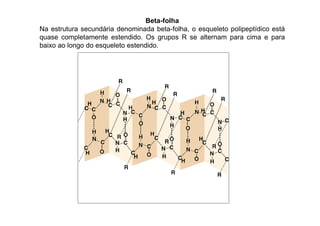
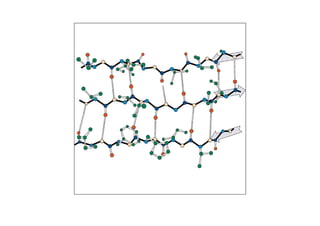
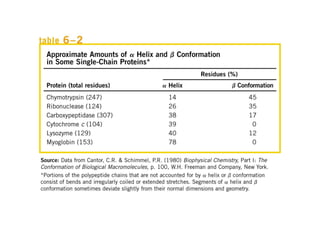
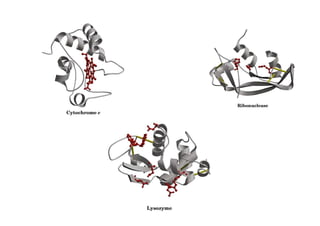
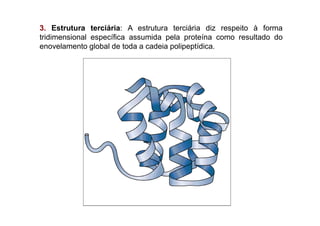
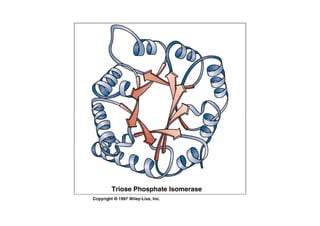
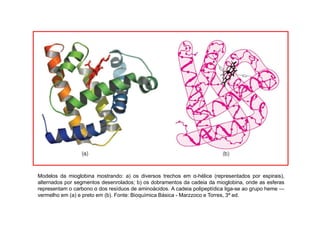
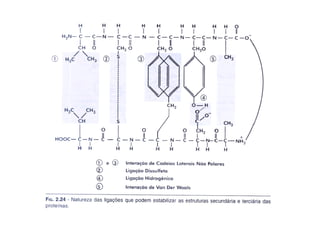
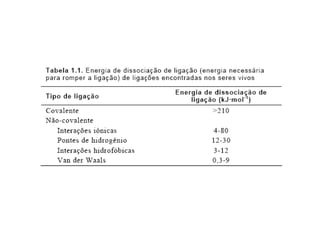
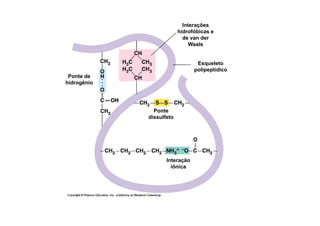
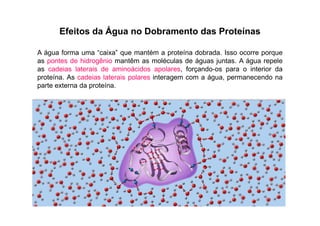
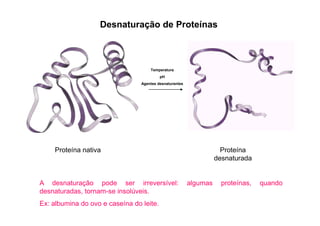
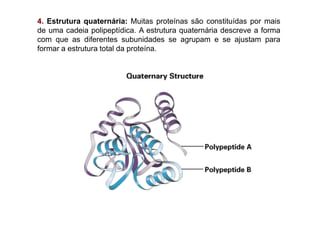
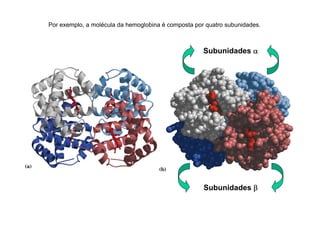
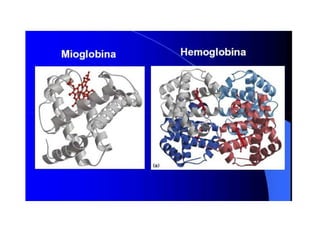
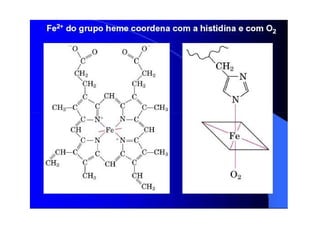
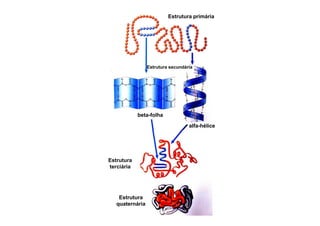
O documento discute as propriedades estruturais das proteínas, definindo-as como compostos orgânicos complexos formados por aminoácidos. Descreve as quatro estruturas das proteínas (primária, secundária, terciária e quaternária) e exemplos de cada uma. Também classifica as proteínas de acordo com sua forma, função e características moleculares.