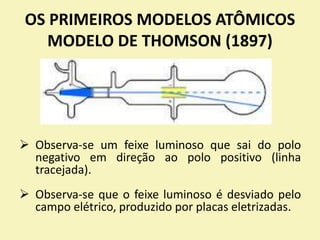
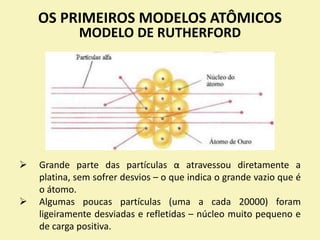
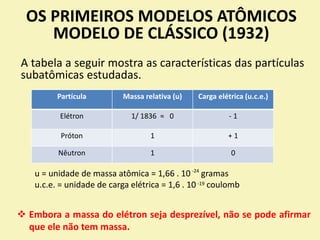
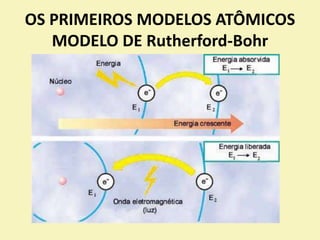
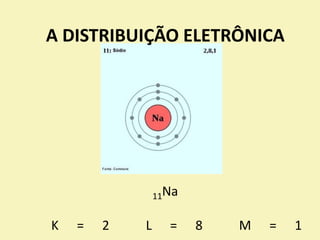
O documento discute os primeiros modelos atômicos propostos por cientistas como Dalton, Thomson, Rutherford e Bohr. Explica que os átomos são constituídos por partículas subatômicas como prótons, nêutrons e elétrons e que esses modelos evoluíram para melhor explicar a estrutura atômica.