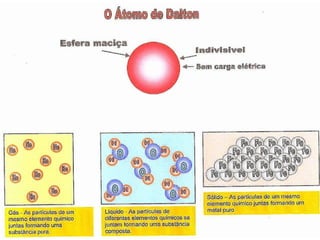
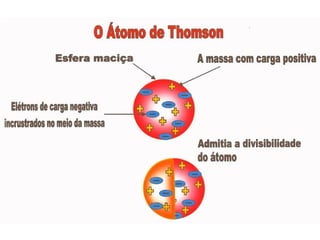
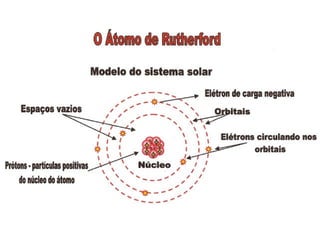
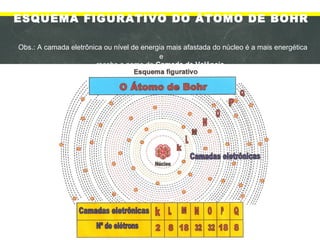
1) O documento discute a evolução dos modelos atômicos desde a Grécia Antiga até o modelo atual, incluindo as contribuições de Demócrito, Dalton, Thomson, Rutherford e Bohr.
2) Os principais pontos abordados são que os átomos são constituídos de prótons, nêutrons e elétrons e que os elétrons orbitam em níveis de energia distintos ao redor do núcleo atômico.
3) O modelo atômico atual, proposto por Bohr, representa os á