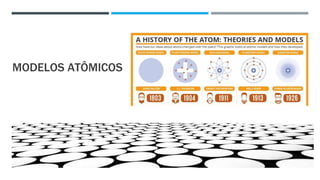
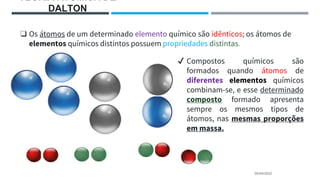
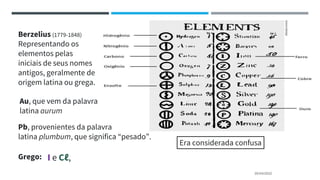
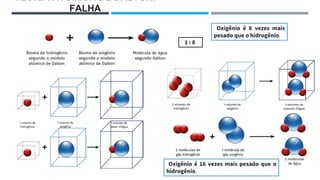
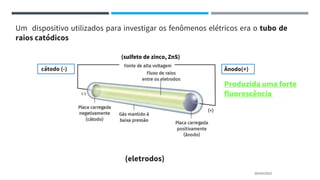
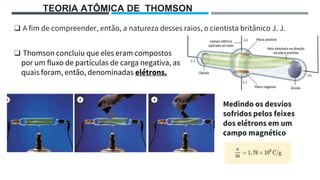
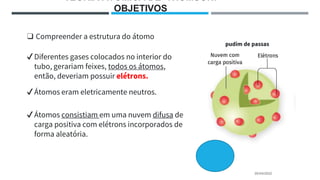
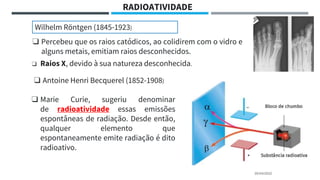
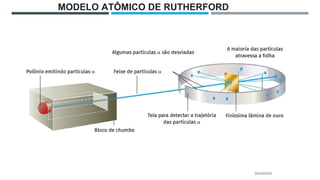
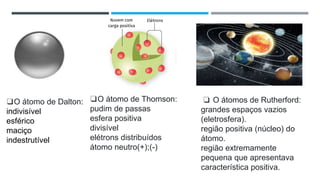
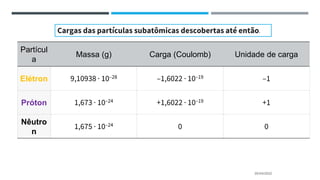
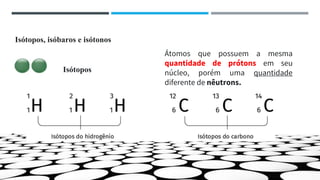
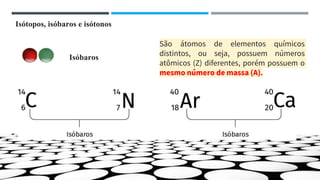
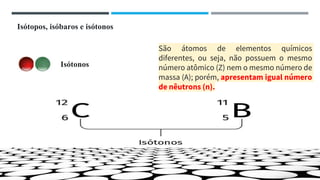
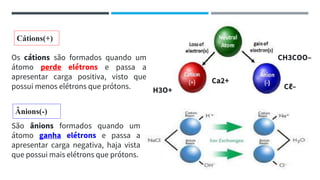
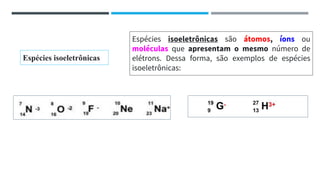
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pela teoria atômica de Dalton e incluindo as contribuições de Thomson, Rutherford, Chadwick e outros. O modelo atômico atual é baseado no núcleo central positivo cercado por elétrons.