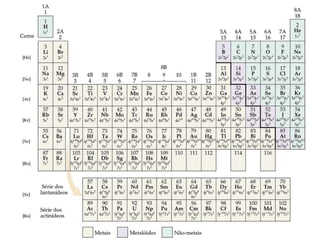
O documento discute as propriedades periódicas dos elementos químicos, incluindo carga nuclear e efetiva, tamanho atômico e iônico, energia de ionização e afinidade eletrônica. A carga nuclear é o número de prótons e a efetiva leva em conta os elétrons internos. O tamanho atômico aumenta ao descer em um grupo e diminui da direita para a esquerda no período. A energia de ionização diminui ao descer em um grupo e aumenta da esquerda para a direita no per