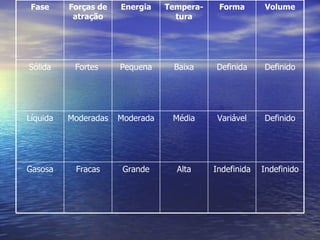
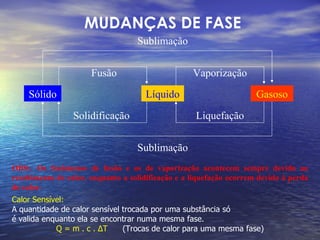
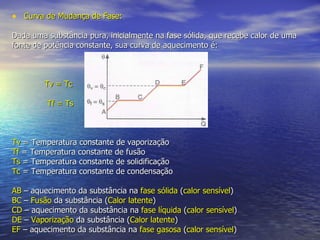
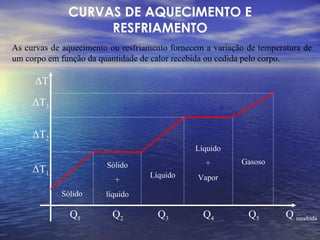
O documento discute as três fases da matéria - sólida, líquida e gasosa - e como elas se relacionam com a temperatura e pressão. Também descreve os processos de mudança de fase, como fusão, solidificação e vaporização, e como a quantidade de calor necessária para essas mudanças permanece constante.