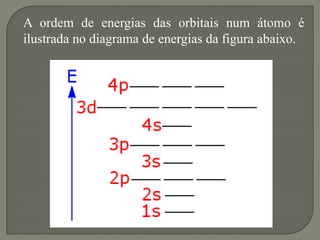
1) O documento discute a configuração eletrônica de átomos, incluindo a ordem de preenchimento das orbitais e a regra de Hund.
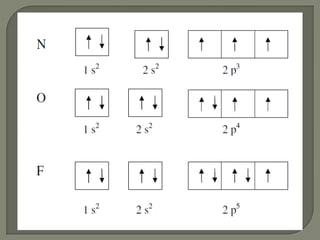
2) É explicado que a configuração eletrônica do carbono é 1s22s22p2 e que segundo a regra de Hund a disposição mais estável é aquela com maior número de spins paralelos.
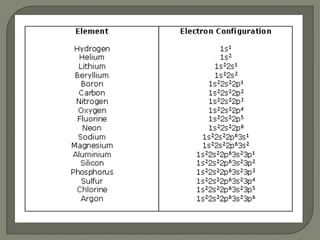
3) Alguns exemplos de configuração eletrônica de elementos como potássio, argônio e cobre são dados para ilustrar o conceito.








![ Como 1s22s22p63s23p6 é a configuração
eletrônica do gás nobre Argônio, podemos
simplificar a configuração eletrônica do potássio
para:
K: [Ar] 4s1](https://image.slidesharecdn.com/configuraoeletrnica-130608123749-phpapp01/85/Configuracao-eletronica-11-320.jpg)
![ Reparem que existem algumas exceções das
regras enunciadas. Considerem-se os elementos
do escândio (Z = 21) ao cobre (Z = 28). A
configuração do cromo é [Ar] 4s13d5 e não
[Ar] 4s23d4. Da mesma forma a configuração do
cobre é [Ar] 4s13d10 e não [Ar] 4s23d9.](https://image.slidesharecdn.com/configuraoeletrnica-130608123749-phpapp01/85/Configuracao-eletronica-13-320.jpg)
