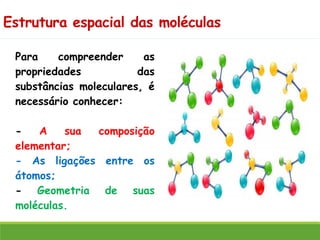
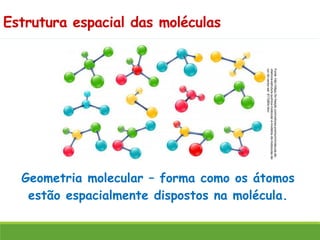
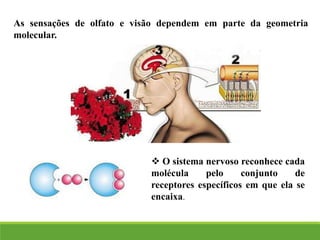
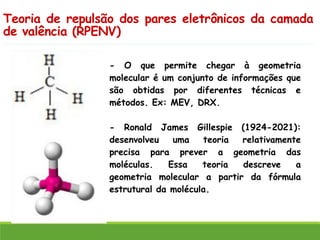
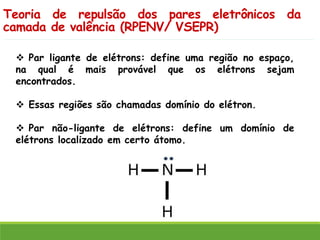
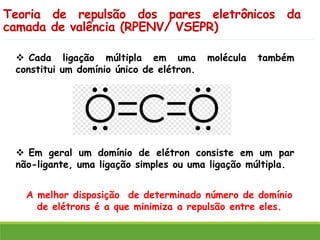
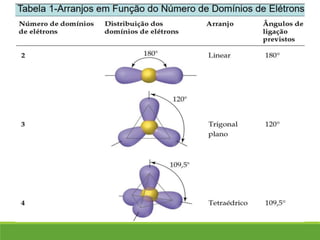
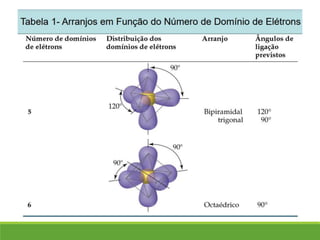
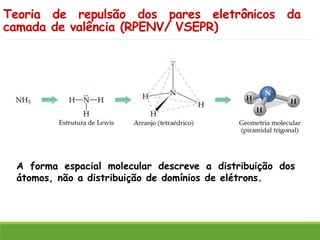
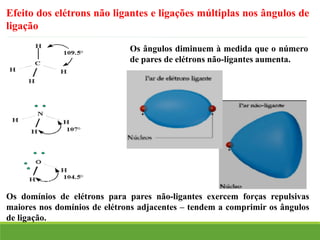
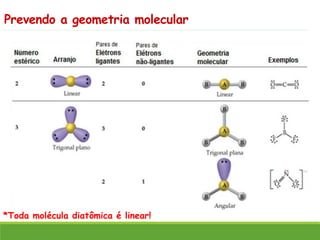
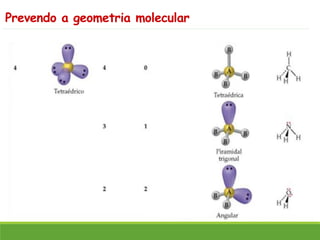
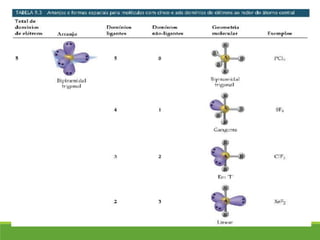
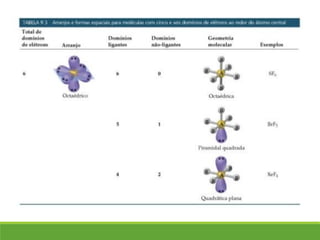
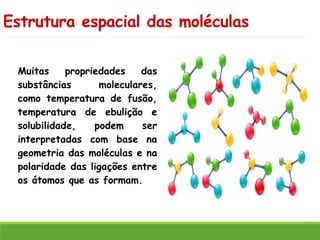
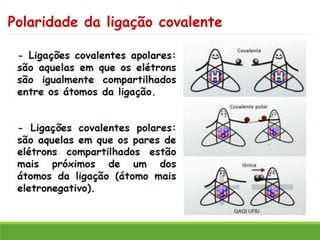
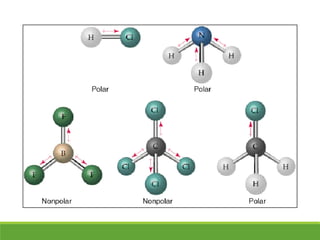
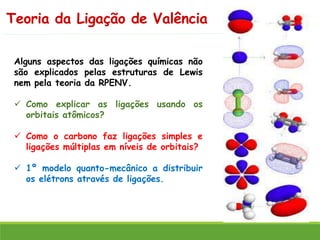
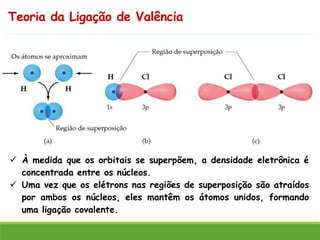
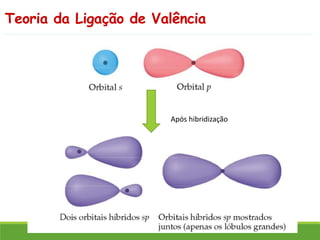
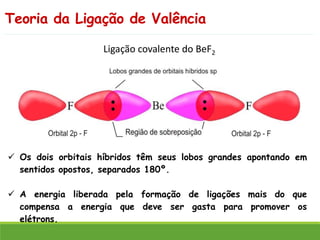
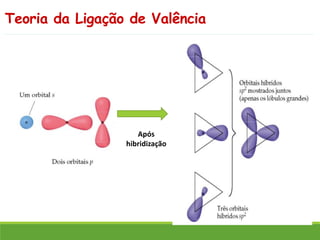
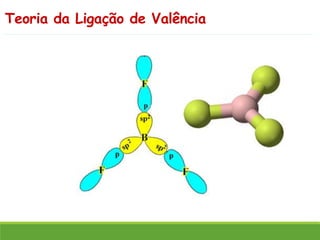
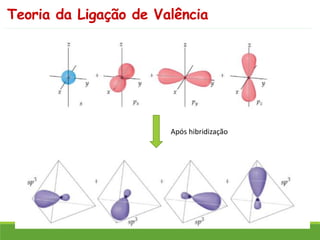
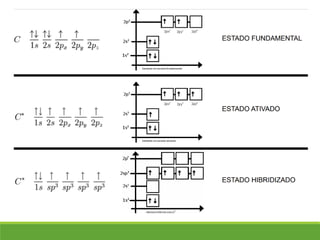
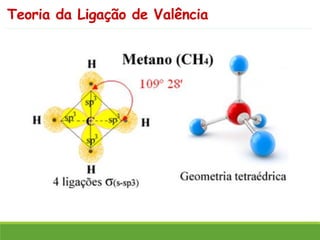
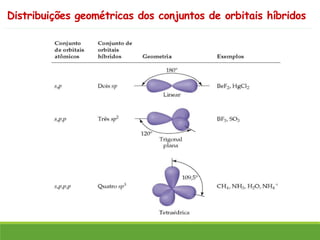
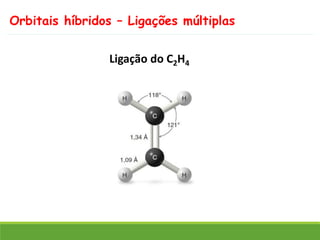
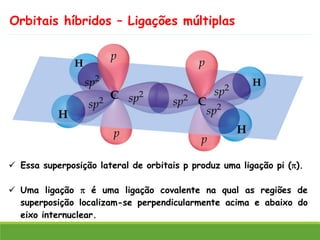
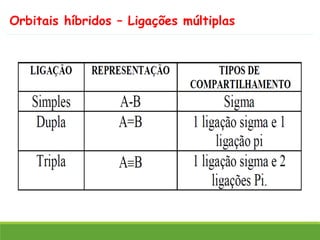
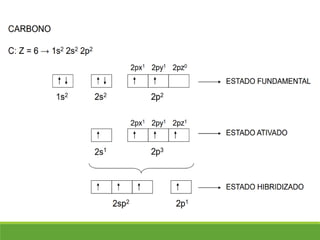
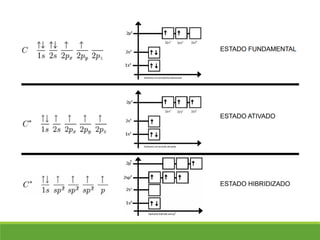
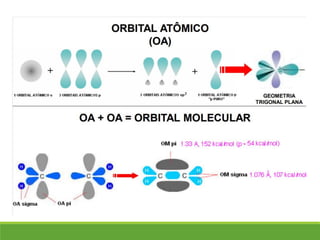
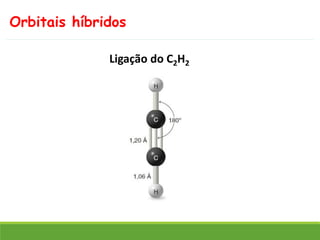
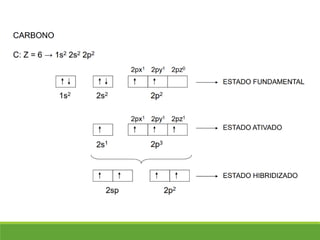
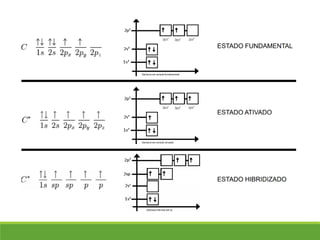
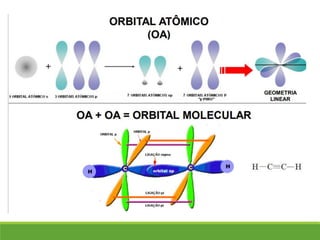
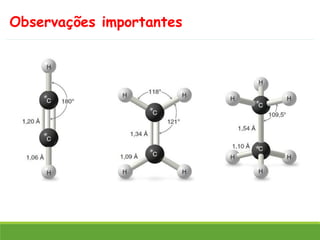
O documento discute a geometria molecular e como prever a forma espacial das moléculas usando a teoria de repulsão dos pares eletrônicos da camada de valência. Explica como a distribuição dos átomos em uma molécula depende do número e arranjo dos domínios eletrônicos ao redor do átomo central. Também aborda como a polaridade das ligações e moléculas está relacionada à geometria molecular.