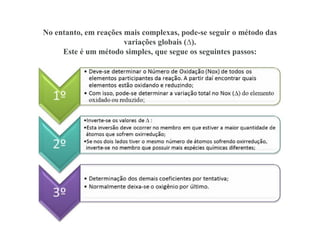
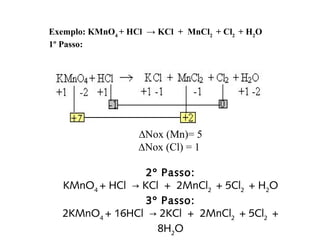
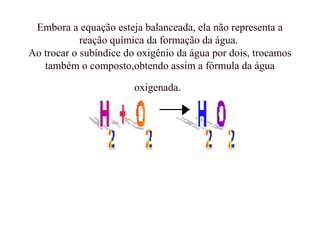
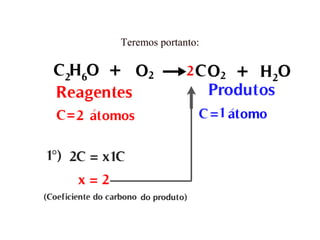
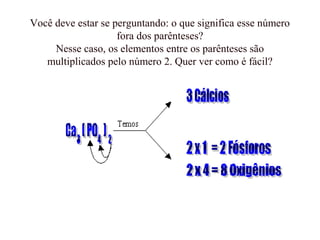
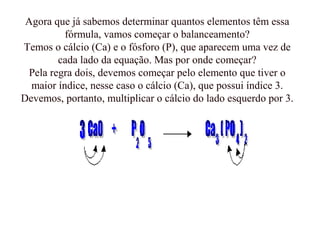
O documento discute os princípios da conservação de massa e da estequiometria em reações químicas, incluindo a Lei de Lavoisier e métodos para balancear equações químicas, como igualar números de elétrons ou usar variações globais. Também explica que os coeficientes estequiométricos devem ser os menores números inteiros possíveis e que não se pode alterar os subíndices das fórmulas químicas.