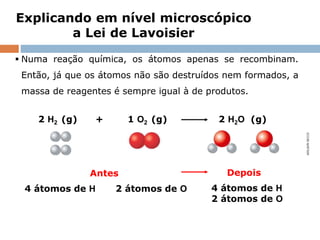
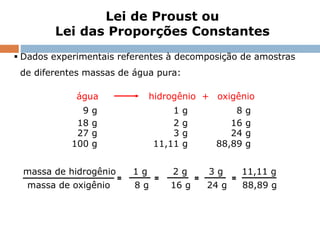
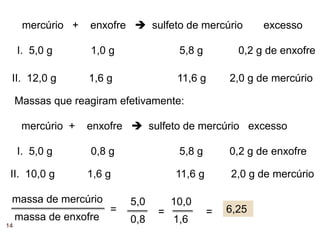
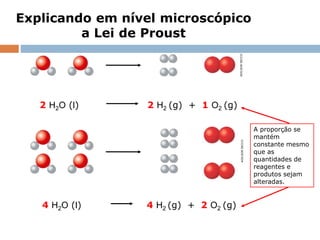
O documento discute a lei da conservação da massa, formulada por Lavoisier, que estabelece que a massa dos reagentes em uma reação química é igual à massa dos produtos em sistemas fechados. Explora exemplos práticos que demonstram essa lei, e também menciona a lei de Proust sobre proporções constantes nas reações químicas. Além disso, aborda a importância histórica de Lavoisier na química moderna e sua influência na derrubada de teorias anteriores como a do flogístico.