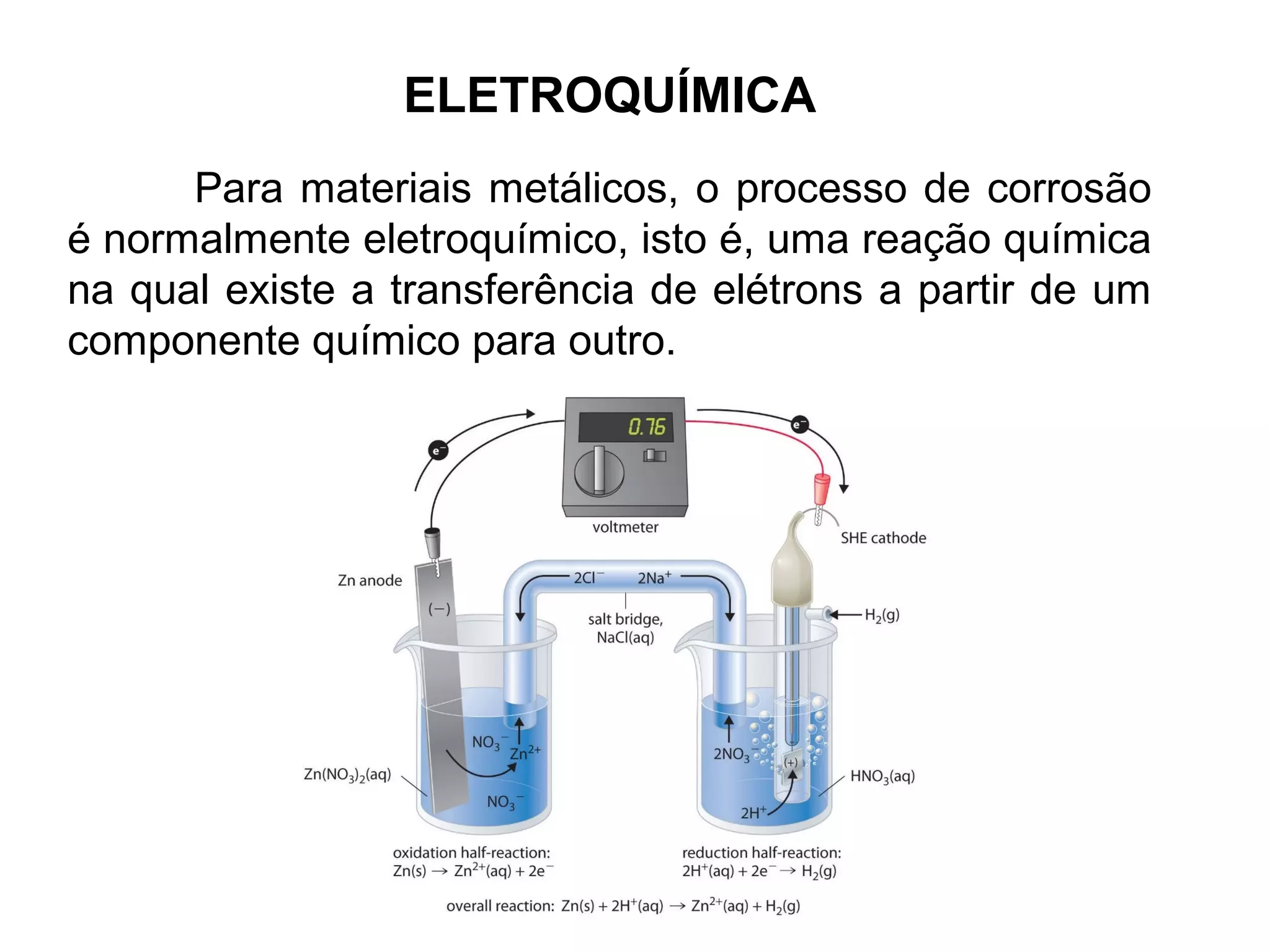
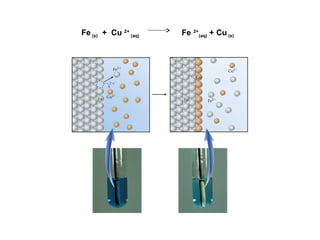
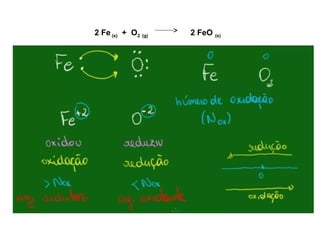
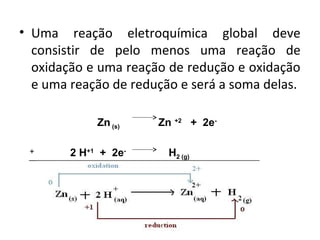
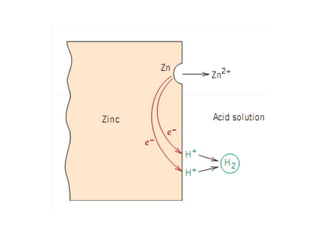
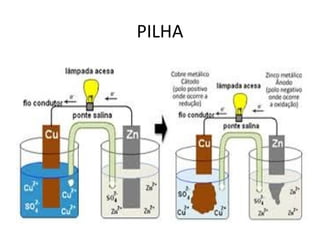
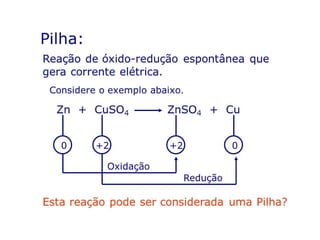
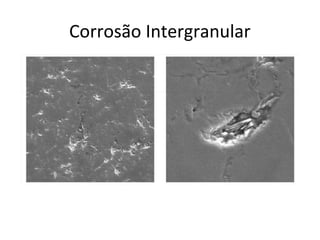
O documento discute processos eletroquímicos de oxidação e redução. A corrosão metálica é geralmente um processo eletroquímico no qual há transferência de elétrons de um metal para outro, levando à oxidação de um e redução do outro. A corrosão pode ocorrer de várias formas, incluindo uniforme, galvânica, em frestas, por pites, intergranular e por lixiviação seletiva.