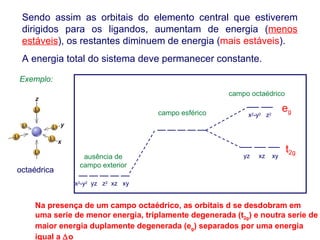
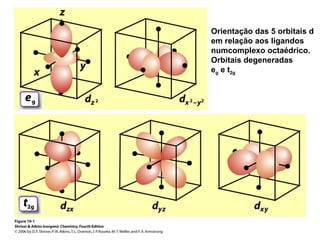
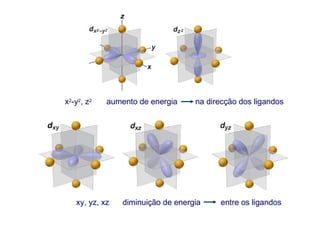
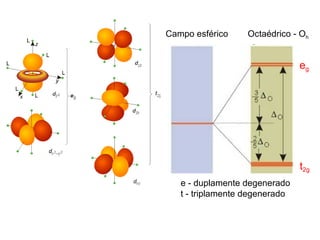
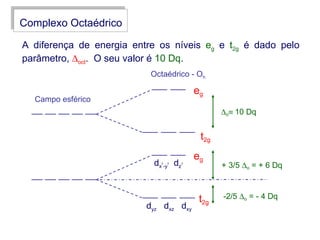
Este documento descreve a teoria do campo cristalino, que explica as propriedades dos compostos de coordenação através da interação entre os orbitais d do metal central e o campo elétrico criado pelos ligantes. A teoria prevê a levantamento da degenerescência dos orbitais d em níveis de energia diferentes e permite interpretar propriedades como os espectros de absorção destes compostos.









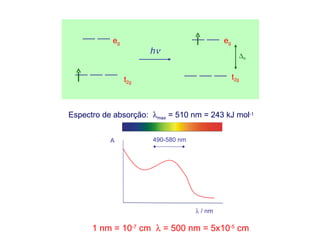
![A propriedade mais simples que pode ser interpretada
através da Teoria do Campo Cristalino é o Espectro de
Absorção dum complexo com um electrão d.
Na figura se mostra o espectro de
Absorção do ião [Ti(H2O)6]3+ com uma
configuração d1.
A Teoria do Campo Cristalino atribui o
primeiro máximo de absorção a 20300
cm-1 à transição entre as orbitais t2g e
as eg . Podemos identificar o valor de
20300 cm-1 com o valor de ∆o
Para complexos com mais de um
electrão é mais difícil obter valores de
Espectro de Absorção do ião [Ti(H2O)6]3+ ∆o](https://image.slidesharecdn.com/campo-cristalino-1-120710164741-phpapp02/85/Campo-cristalino-1-16-320.jpg)
![3+
EXEMPLOS: 3+
• Configuração electrónica: d1
[Ti(OH2)6]3+
Cor violeta
eg
3/5 ∆oct
2/5 ∆oct
t2g
1 electrão t2g
EECL= 1 x ( 2/5 )∆oct](https://image.slidesharecdn.com/campo-cristalino-1-120710164741-phpapp02/85/Campo-cristalino-1-17-320.jpg)