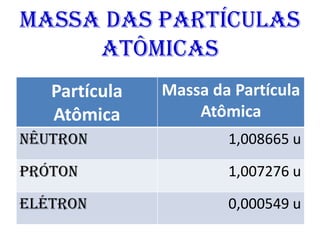
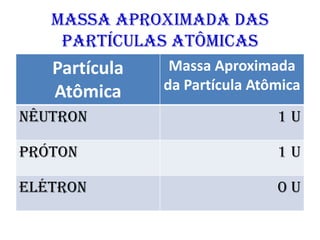
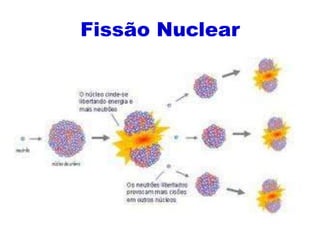
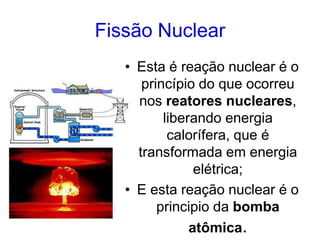
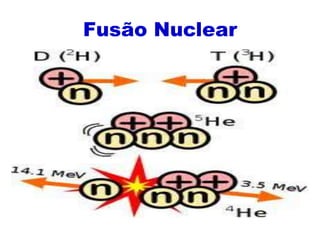
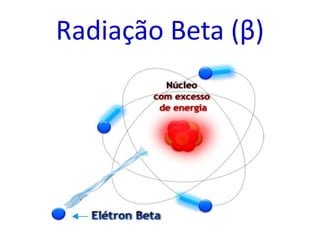
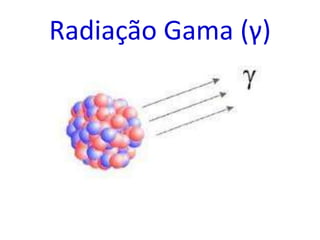
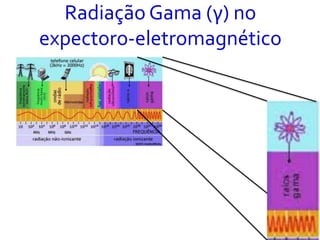
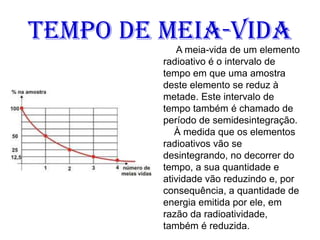
O documento abrange conceitos fundamentais sobre átomos, incluindo isótopos, isóbaros, isótonos e alótropos, bem como a massa atômica e as reações de fissão e fusão nuclear. Além disso, discute a radioquímica, radiações emitidas por núcleos radioativos, e a meia-vida de isótopos, juntamente com suas aplicações na medicina e outras áreas. A informação é organizada para fornecer uma visão geral da estrutura atômica e das implicações das radiações.