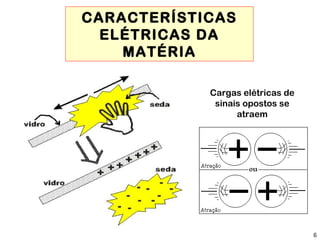
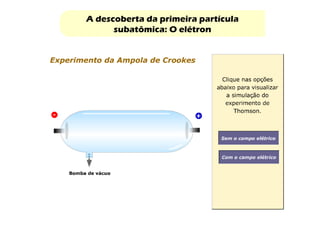
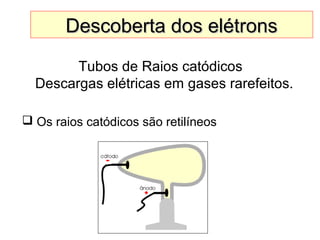
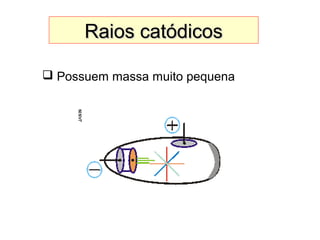
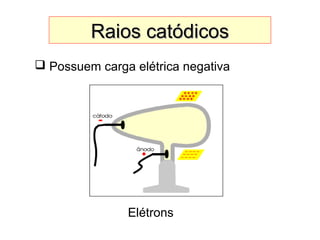
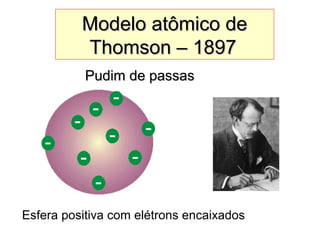
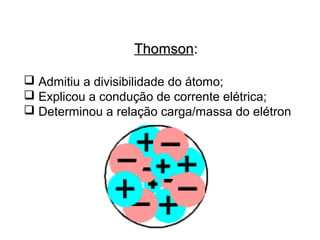
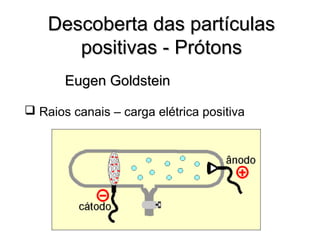
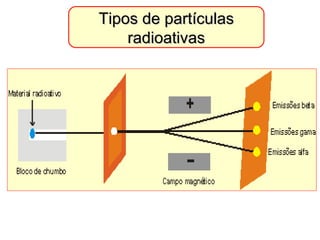
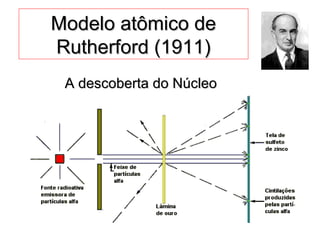
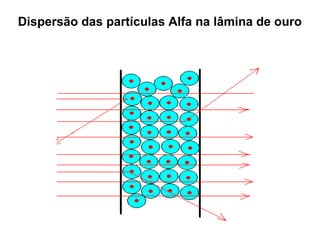
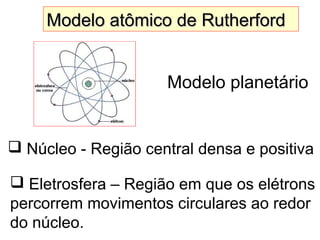
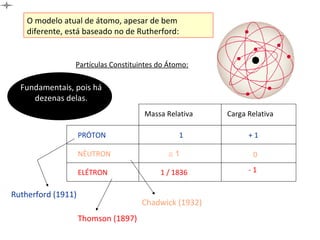
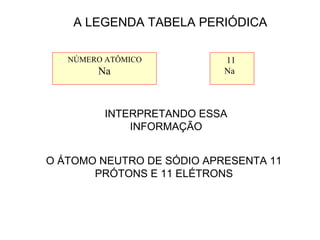
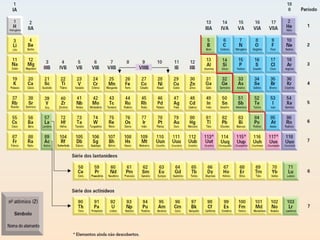
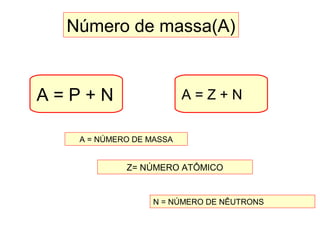
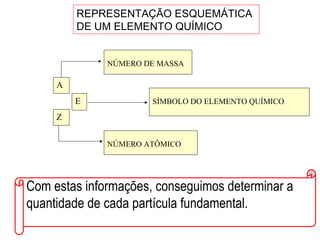
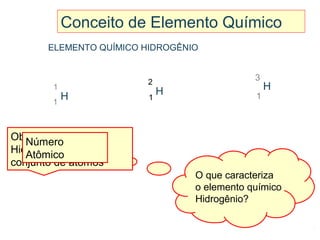
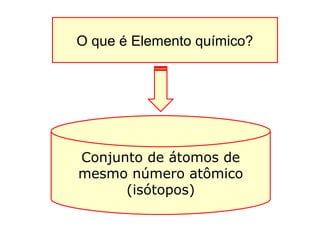
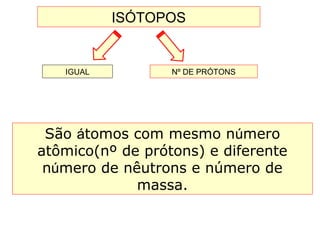
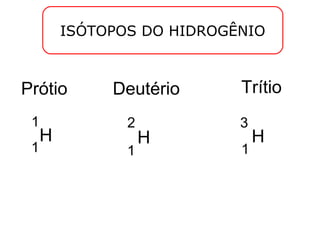
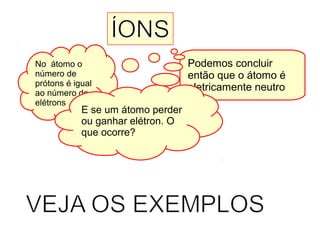
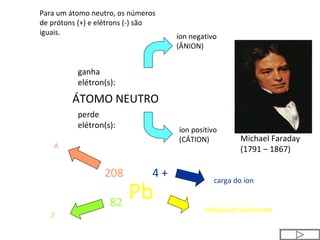
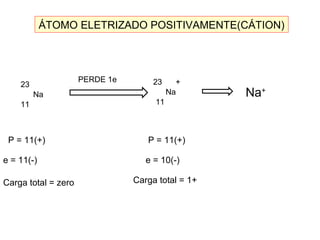
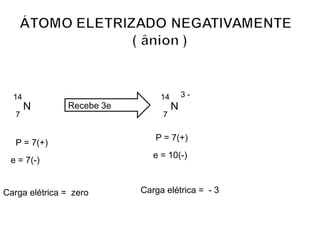
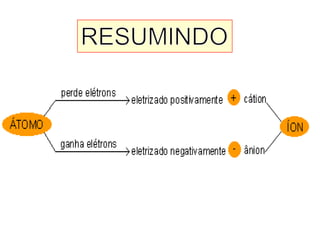
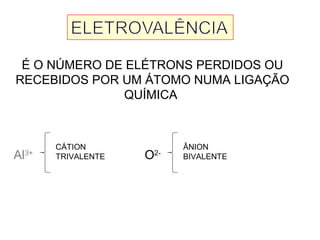
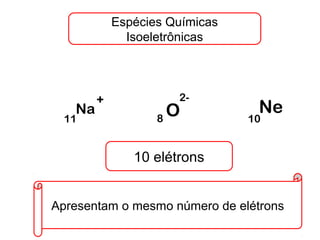
Este documento discute a evolução do modelo atômico ao longo do tempo, desde o modelo de Dalton em 1803 até o modelo atual. Apresenta as principais descobertas e modelos propostos por cientistas como Thomson, Rutherford, Chadwick que levaram à compreensão moderna da estrutura atômica.