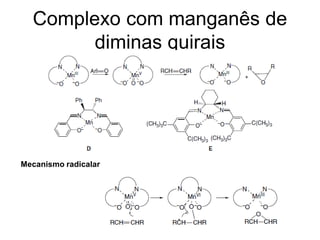
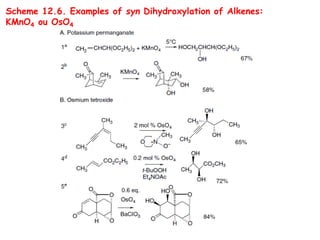
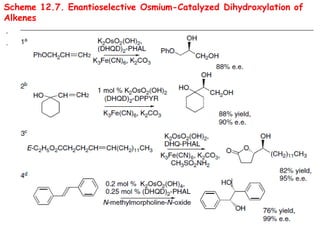
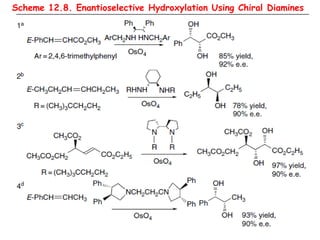
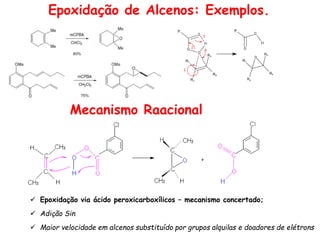
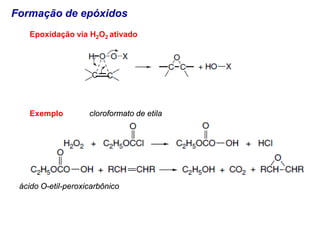
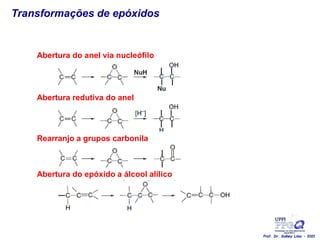
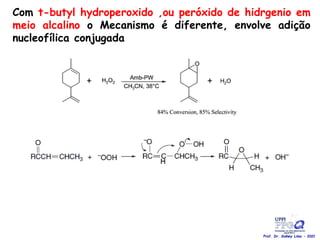
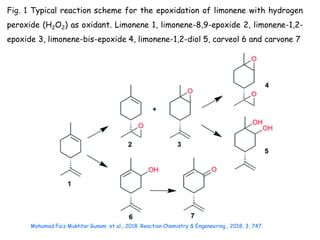
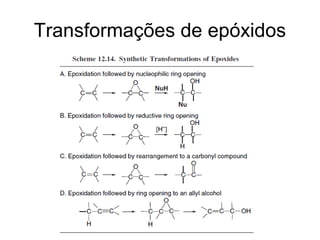
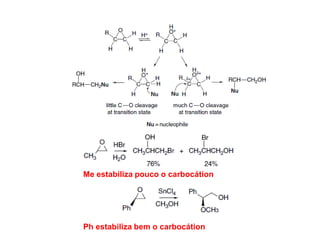
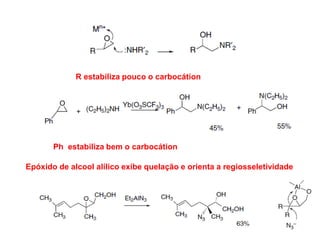
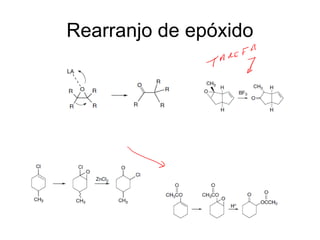
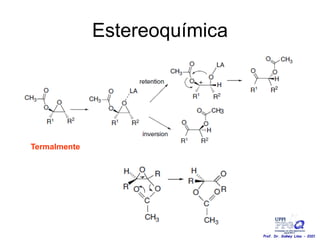
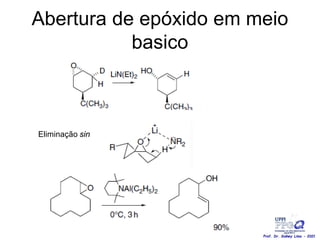
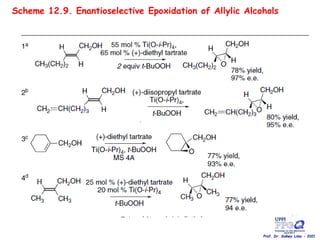
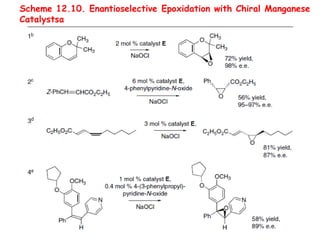
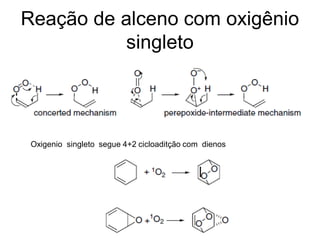
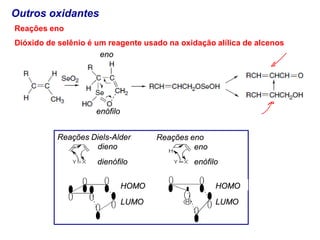
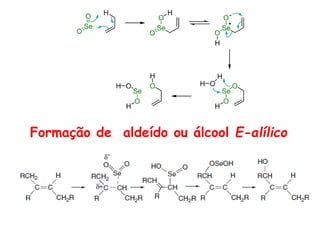
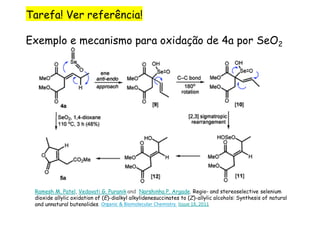
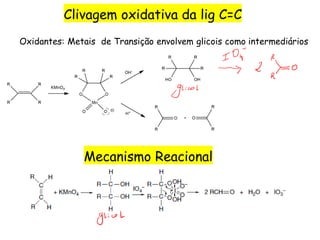
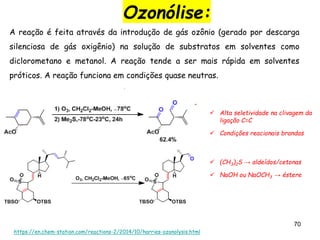
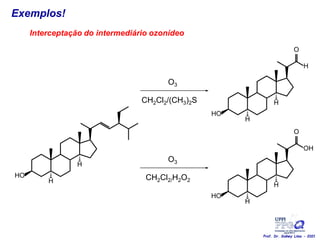
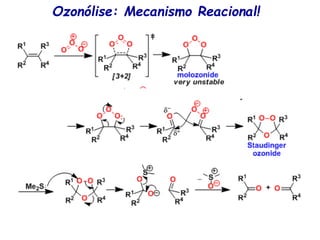
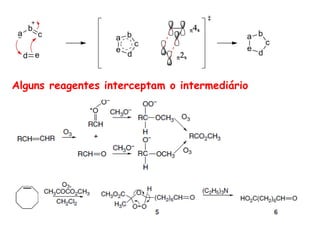
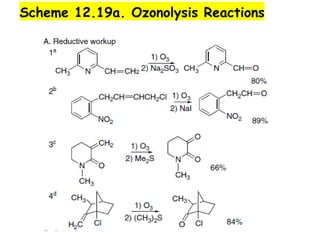
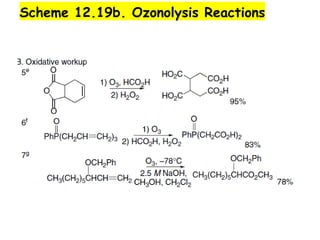
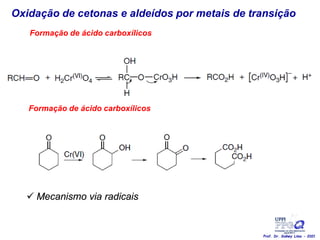
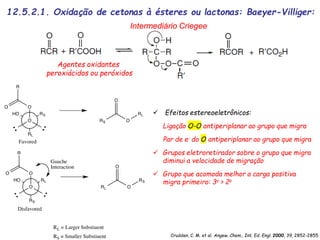
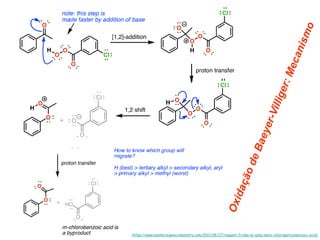
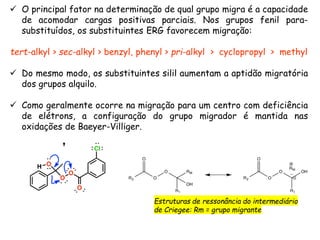
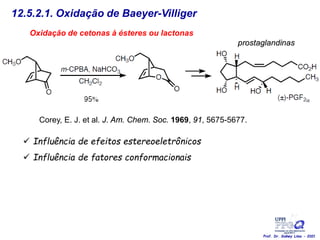
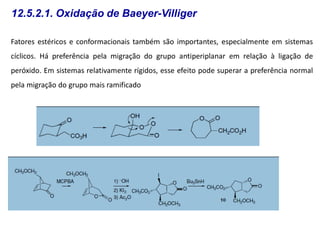
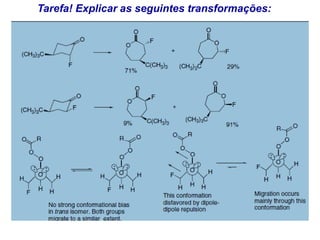
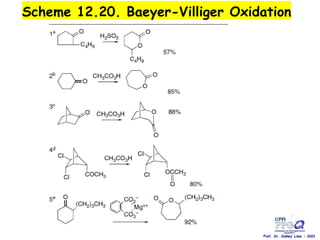
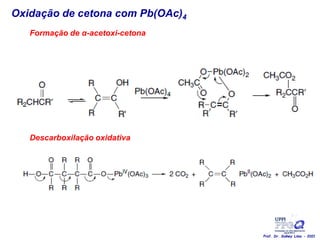
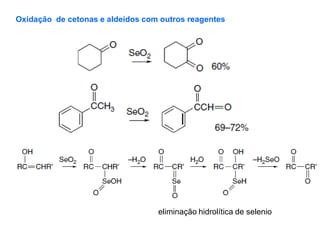
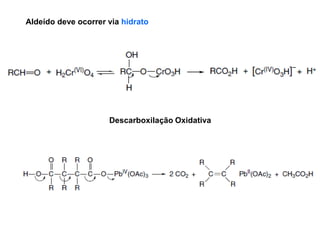
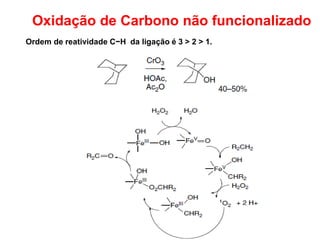
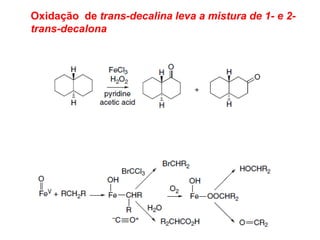
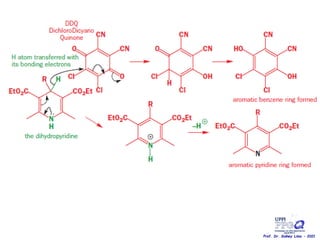
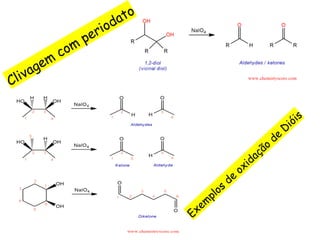
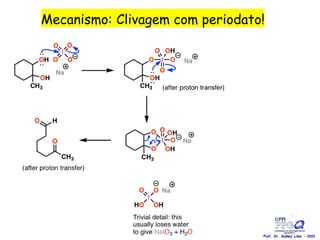
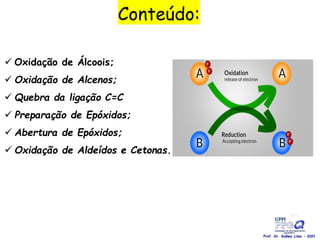
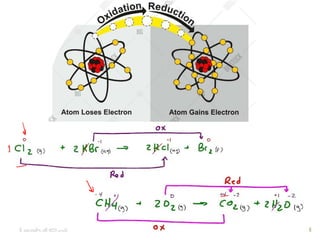
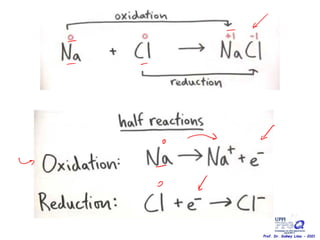
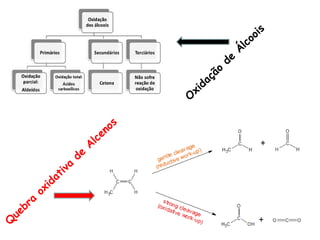
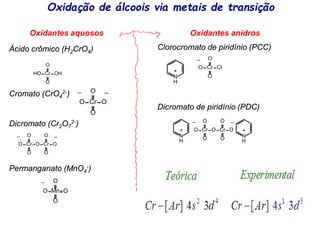
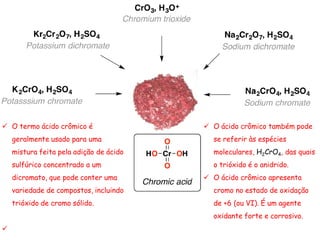
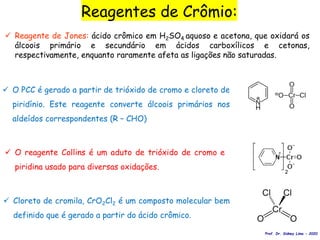
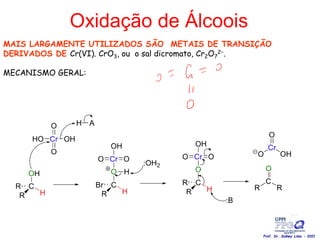
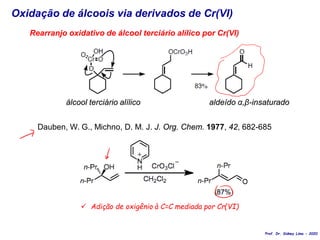
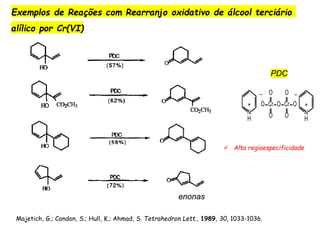
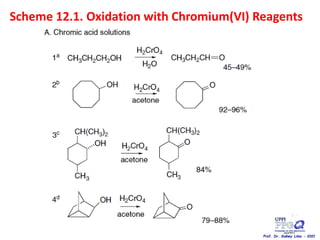
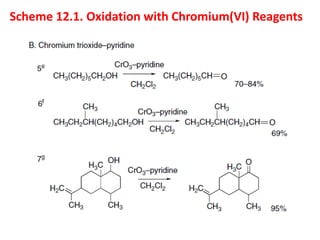
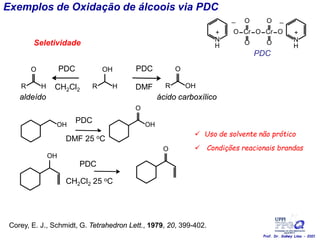
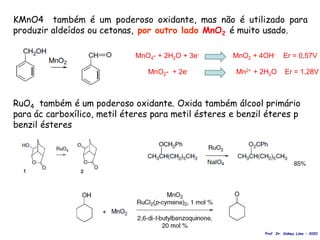
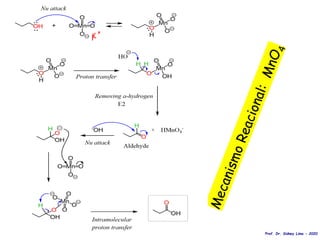
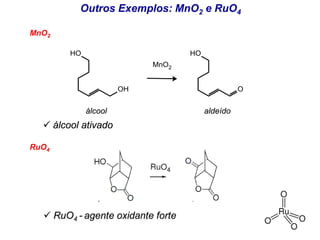
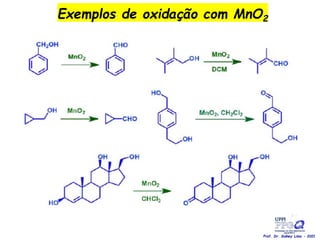
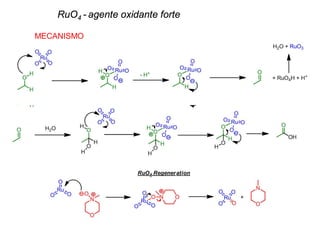
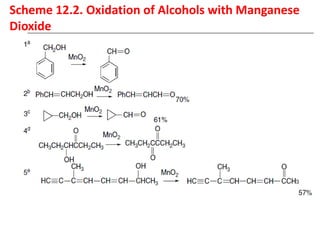
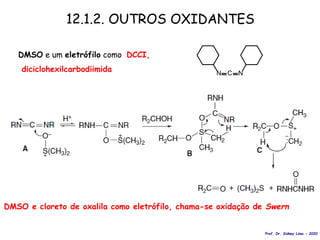
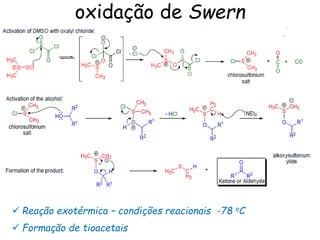
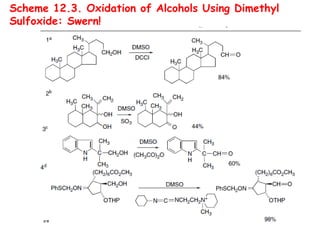
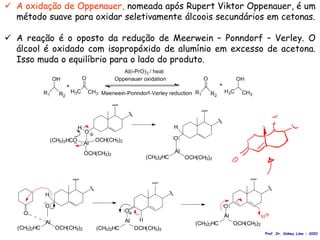
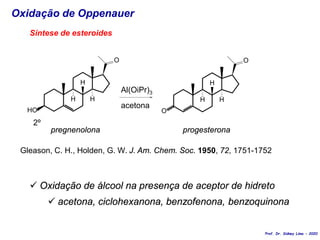
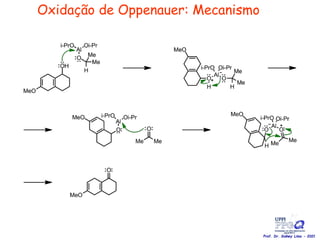
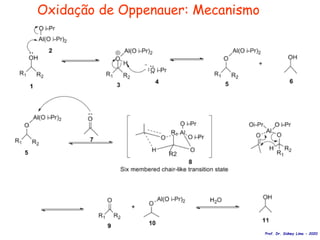
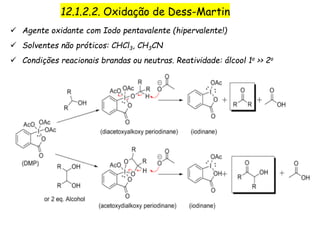
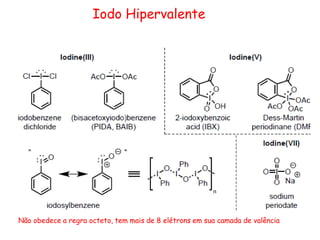
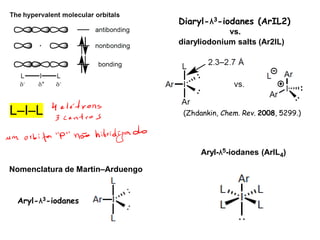
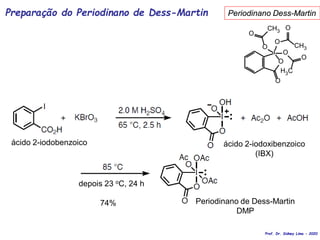
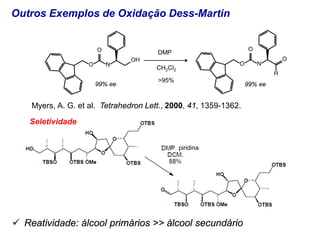
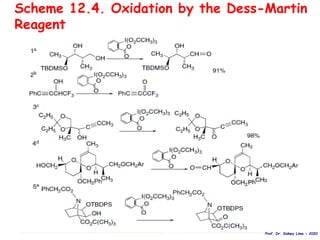
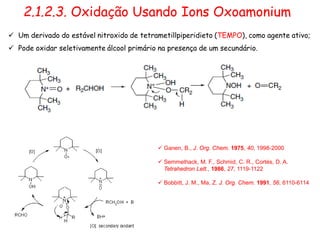
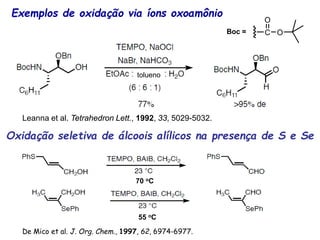
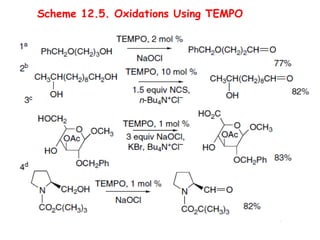
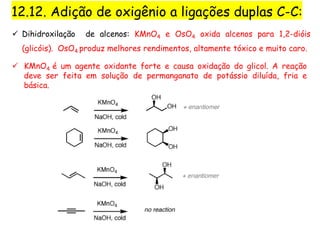
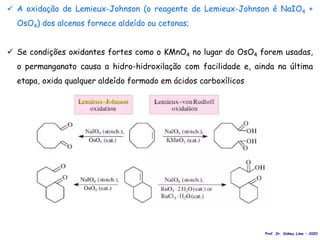
O documento discute vários tipos de oxidações de compostos orgânicos utilizando agentes oxidantes como derivados de cromo, permanganato de potássio, dióxido de manganês e tetróxido de rútio. É apresentado o mecanismo e exemplos de oxidação de álcoois, alcenos e epóxidos.






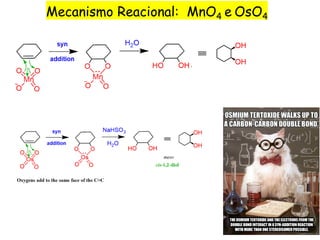
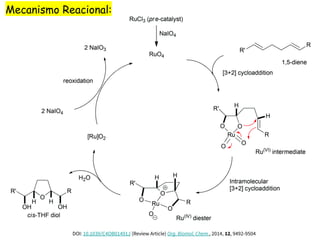
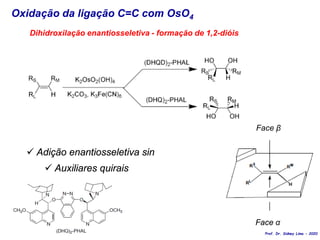
![ Adição estereoespecífica sin – cicloadição [3+2];
OsO4 (tóxico, preço) – condições catalíticas
Exemplo: RuO4, em peroxomonosulfato de potássio
Prof. Dr. Sidney Lima - 2021](https://image.slidesharecdn.com/8-210705010838/85/8-R-Oxidacao-Prof-Sidney-UFPI-45-320.jpg)