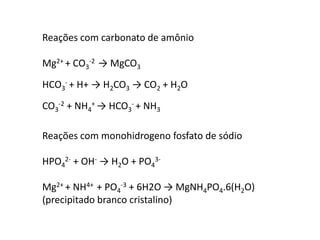
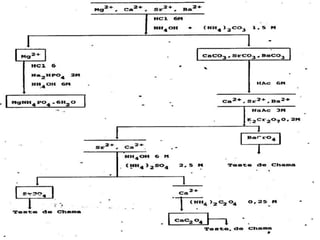
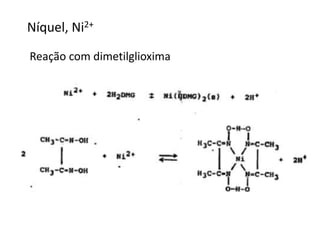
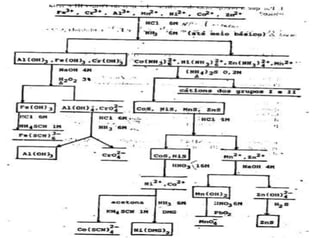
1) O documento descreve procedimentos para análise qualitativa de cátions e ânions por via úmida, incluindo reações para identificação de íons de diferentes grupos.
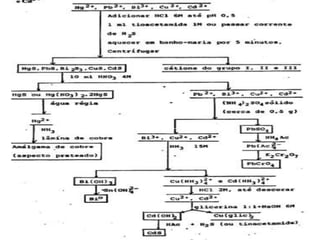
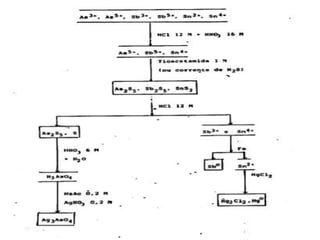
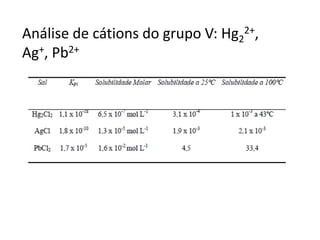
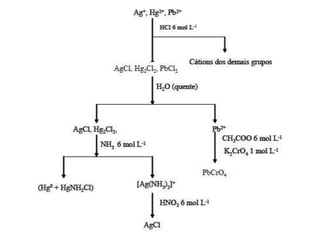
2) É apresentada uma classificação de cátions em cinco grupos, com descrição das propriedades e reações características de cada grupo.
3) Reações com reagentes como sulfeto de amônio, dicromato de potássio e nitroprussiato de sódio são usadas para separar e identificar cátions dos grupos.




![Reações dos íons potássio (K+)
3K+ + [Co(NO2)6]3- + → K3 [Co(NO2)6]3-
Para fazer este teste, junta-se 3 gotas de uma solução de
cloreto potássio 0,2 M, 3 gotas de ácido acético 3 M e um
mesmo volume de acetato de sódio 3 M num tubo de ensaio.
Adiciona-se 6 gotas de solução de cobaltonitrito de sódio0,2
M, recentemente preparada. Se o precipitado não se formar
de imediato, deixa-se o tubo repousar por alguns minutos.
2K+ + Ag+ + [Co(NO2)6]3- + →
K2Ag[Co(NO2)6]3-
3NO2
- + 2H+ → NO + H2O + NO3-](https://image.slidesharecdn.com/aulacationseanionsviaumida-141210105811-conversion-gate01/85/Aula-cations-e-anions-via-umida-5-320.jpg)

![Reações do íon amônio, NH4+
+ + [Co(NO2)6]3- + → (NH4)3 [Co(NO2)6]3-
3NH4
+ + OH- → NH3 + H2O
NH4
NH3(g) + HCl(g) → NH4Cl(s)](https://image.slidesharecdn.com/aulacationseanionsviaumida-141210105811-conversion-gate01/85/Aula-cations-e-anions-via-umida-7-320.jpg)


















![É possível ver na Tabela
que se [H+] for muito
grande, pode haver uma
precipitação incompleta
de Pb2+ e Cd2+. Por
outro lado se [H+] for
muito baixa, pode
permitir o ínicio da
precipitação do níquel,
cobalto e zinco, que são
cátions do grupo III.](https://image.slidesharecdn.com/aulacationseanionsviaumida-141210105811-conversion-gate01/85/Aula-cations-e-anions-via-umida-30-320.jpg)





![Cobre (II)
Reação com Ferrocianeto de potássio formando um precipitado
castanho avermelhado
2Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6](s)
Determinação de Cd2+ na presença de Cu2+](https://image.slidesharecdn.com/aulacationseanionsviaumida-141210105811-conversion-gate01/85/Aula-cations-e-anions-via-umida-36-320.jpg)