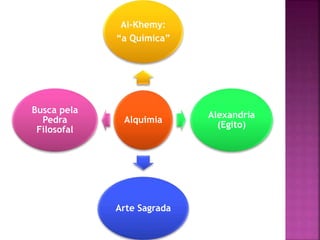
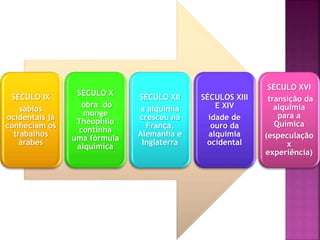
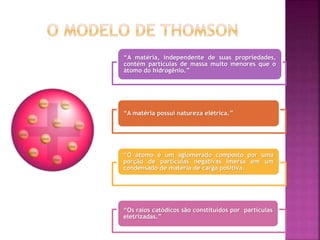
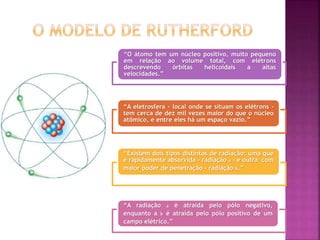
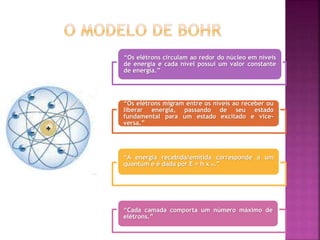
O documento descreve a evolução da compreensão do átomo desde a alquimia até a física quântica, mencionando figuras-chave como Dalton, Thomson, Rutherford, Bohr, Schrödinger e suas contribuições, como a teoria atômica, a descoberta do elétron, a estrutura nuclear do átomo e a equação de Schrödinger.