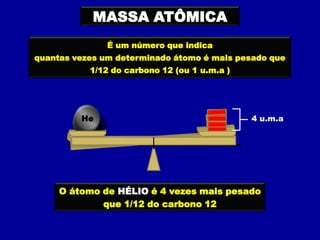
1. A unidade de massa atômica (u.m.a.) é definida como 1/12 da massa do isótopo carbono-12.
2. A massa atômica de um elemento é o número que indica quantas vezes um átomo é mais pesado que 1 u.m.a.
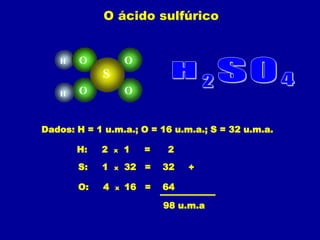
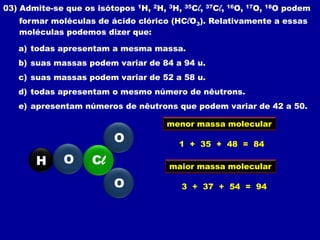
3. A massa molecular é um número que indica quantas vezes uma molécula é mais pesada que 1 u.m.a. e é calculada somando as massas atômicas dos átomos que formam a molécula.