1) O documento apresenta 10 questões objetivas e discursivas sobre conceitos de química como modelos atômicos, ligações iônicas e moleculares, fórmulas estruturais e eletrônicas.
2) São solicitadas informações como a massa de substâncias em reações químicas, leis da conservação da massa e proporções constantes.
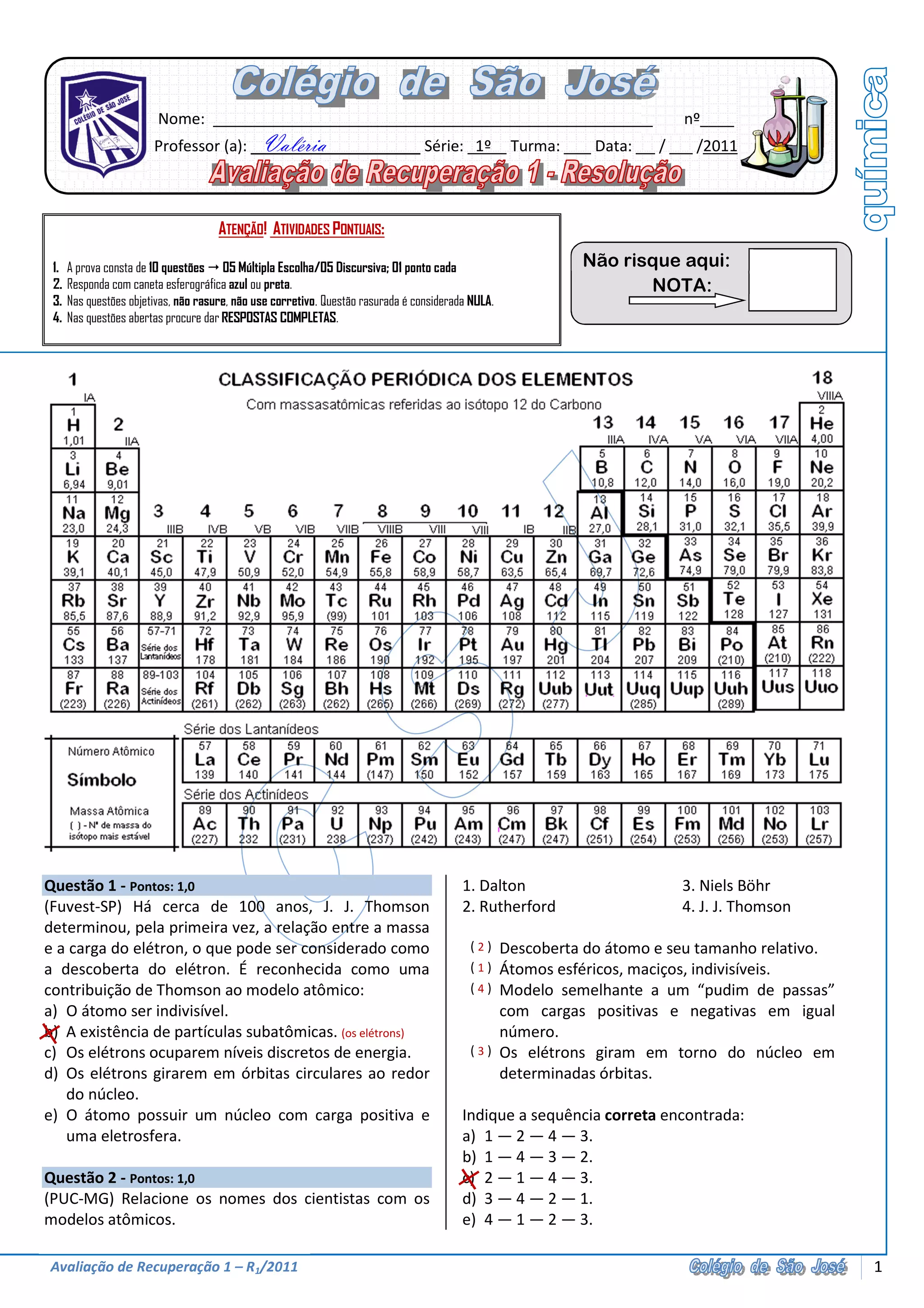
3) Há também perguntas sobre elementos da tabela periódica e sua combinação com hidrogênio.