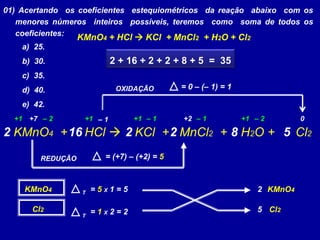
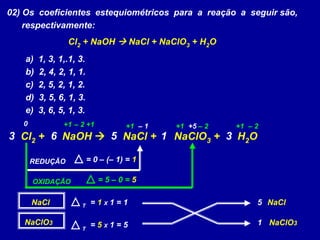
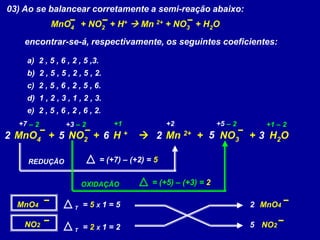
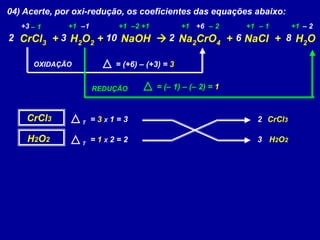
Este documento apresenta métodos para balancear equações químicas, incluindo o método das tentativas e o método de oxi-redução. O método das tentativas envolve atribuir coeficientes literais às substâncias e resolver um sistema de equações para determinar os coeficientes. O método de oxi-redução se baseia no princípio de que o total de elétrons cedidos deve ser igual ao total recebido, calculando variações no número de oxidação dos elementos.