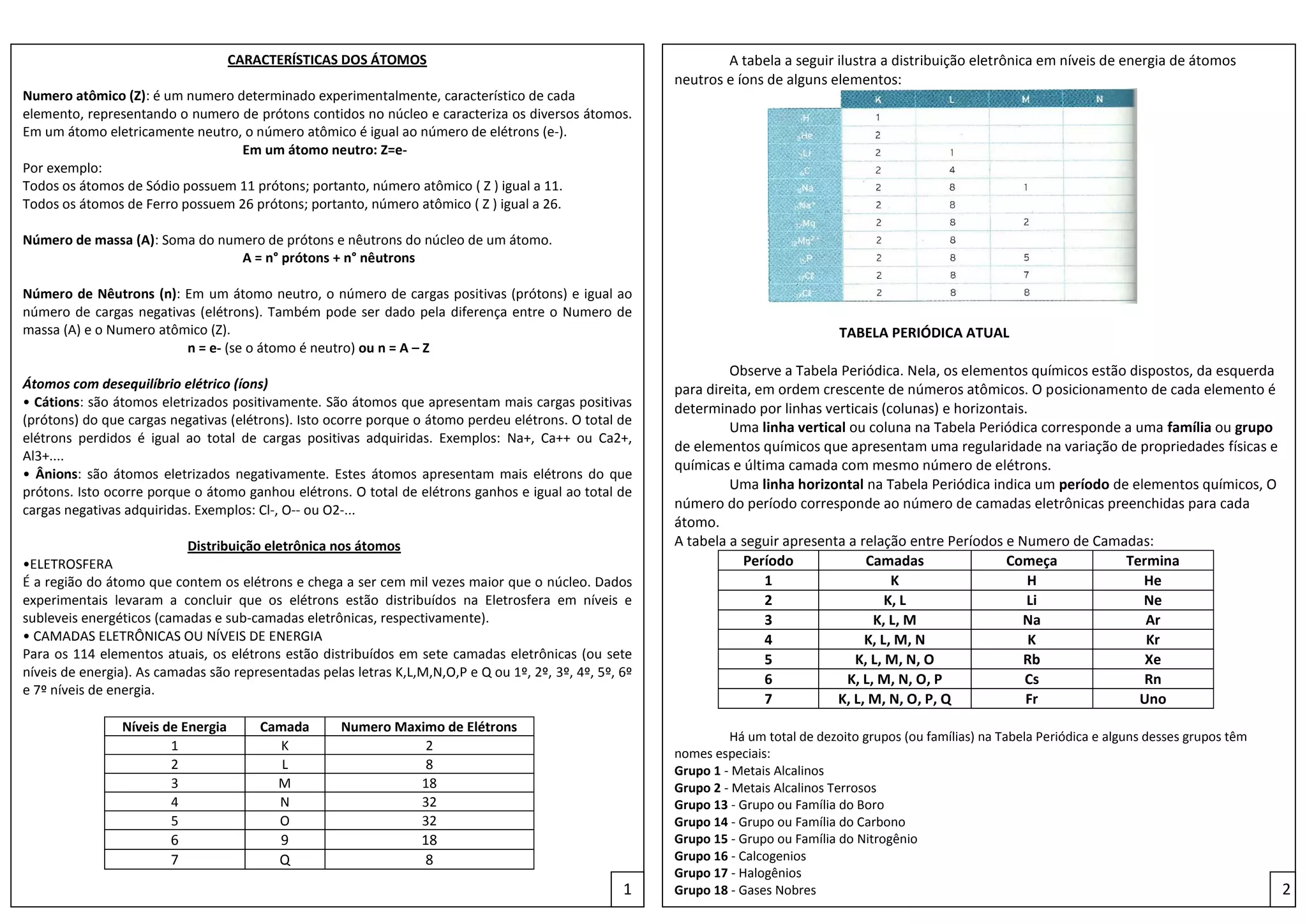
1) O documento descreve as características dos átomos, incluindo o número atômico, número de massa, distribuição eletrônica e tipos de ligações químicas.
2) O número atômico representa o número de prótons no núcleo e caracteriza os diferentes átomos, enquanto o número de massa é a soma de prótons e nêutrons.
3) A distribuição eletrônica ocorre em camadas (K, L, M, etc.), com cada camada tendo um número máximo de elétr