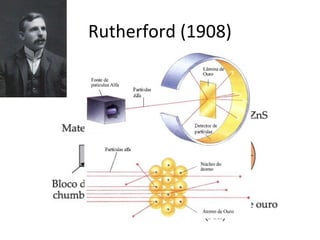
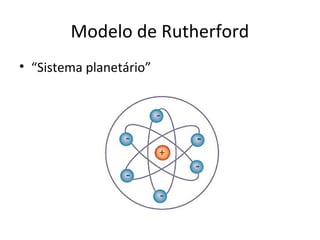
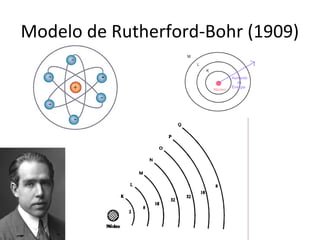
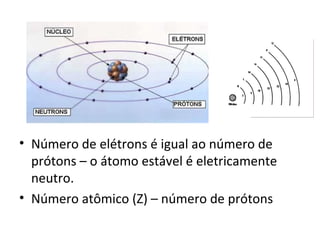
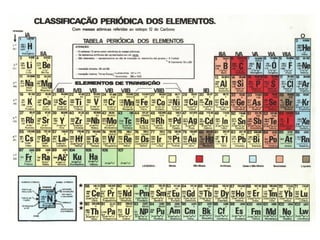
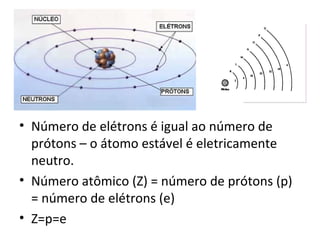
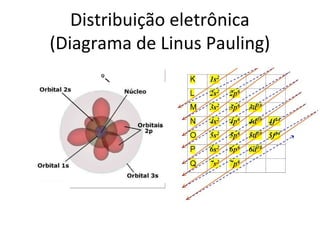
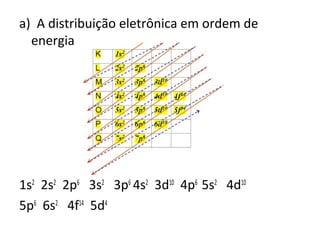
O documento descreve a evolução dos modelos atômicos ao longo do tempo, incluindo os modelos de Dalton, Thomson, Rutherford e Rutherford-Bohr. Também discute conceitos-chave como número atômico, número de massa, elétrons, prótons e nêutrons. Por fim, faz perguntas sobre a distribuição eletrônica de um átomo de tungstênio.