1) O documento apresenta os objetivos e conteúdo de uma disciplina de Química Ambiental.
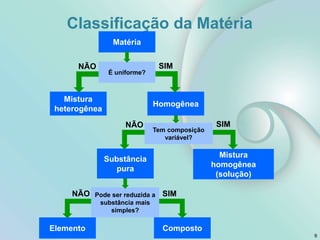
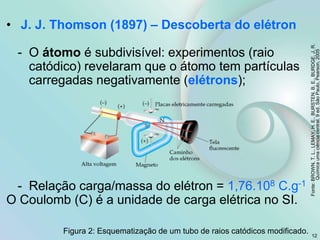
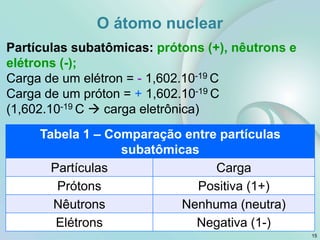
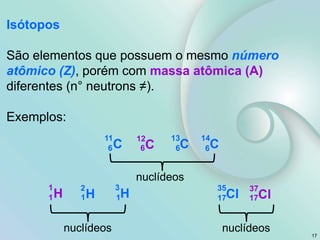
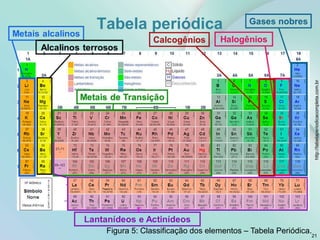
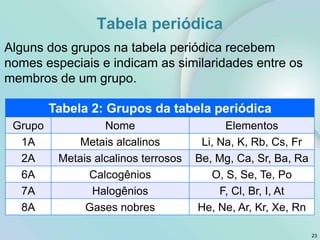
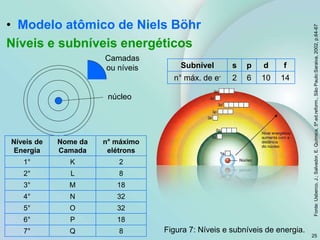
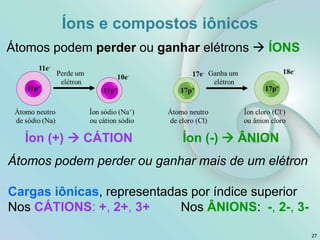
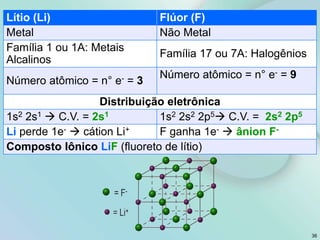
2) Os tópicos incluem matéria e teoria atômica, tabela periódica, ligações químicas, compostos iônicos e moleculares.
3) O curso visa relacionar questões de Química Ambiental aos impactos ambientais mais comuns para propor soluções.