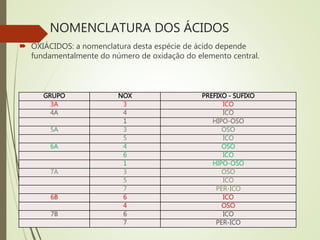
O documento define e classifica as principais funções químicas: ácidos, bases, sais e óxidos. Apresenta as teorias de Arrhenius, Bronsted-Lowry e Lewis para definir ácidos e bases. Explica a classificação desses compostos quanto à composição, número de íons liberados e força. Também descreve a nomenclatura padrão de cada função.