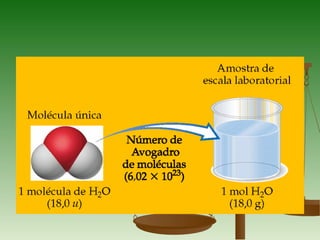
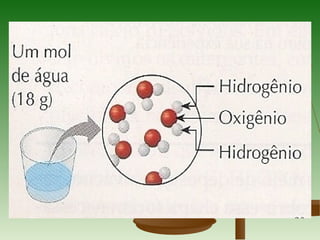
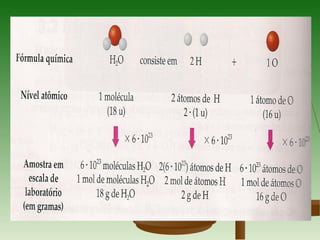
1) O documento discute conceitos fundamentais de cálculos químicos como massa atômica, massa molecular, massa molar e mol.
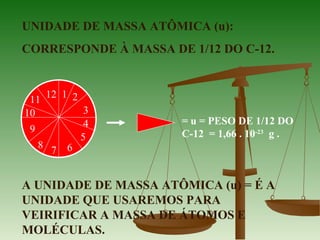
2) A unidade de massa atômica u corresponde à massa de 1/12 do isótopo C-12 e é usada para comparar as massas de átomos e moléculas.
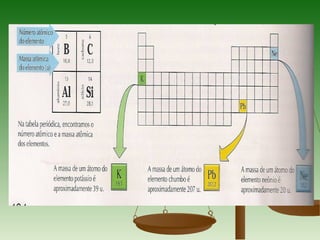
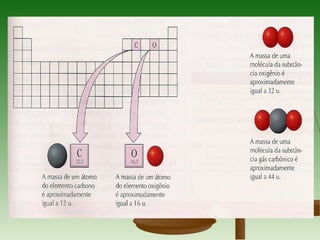
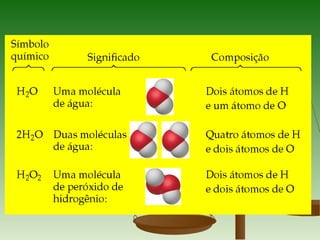
3) A massa molar de um elemento é a massa de um mol de seus átomos em gramas, enquanto a massa molar de uma substância pura é a massa de um mol de suas molécul