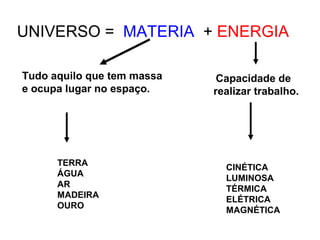
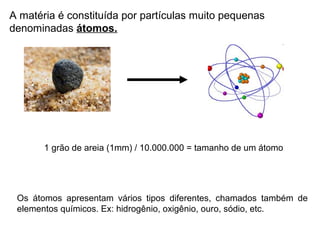
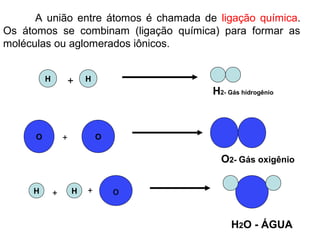
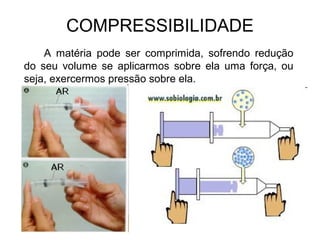
O documento resume conceitos básicos de química, incluindo:
1) A matéria é constituída por átomos que se combinam formando moléculas ou aglomerados iônicos;
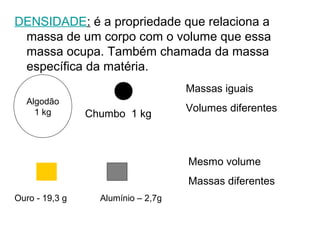
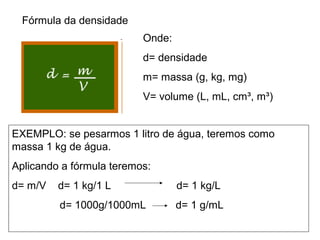
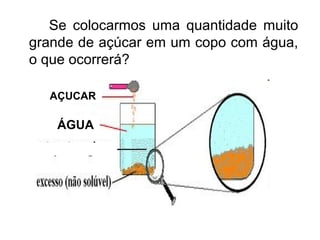
2) A matéria possui propriedades gerais como extensão, massa e impenetrabilidade e propriedades específicas que dependem de sua composição;
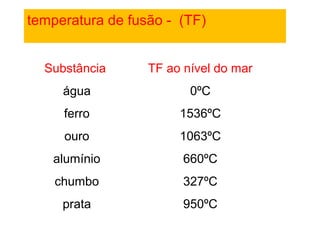
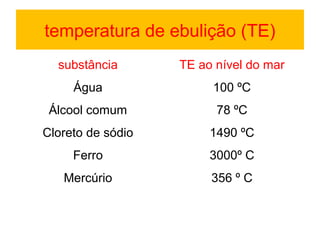
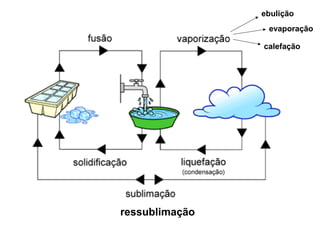
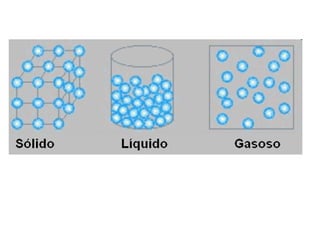
3) A matéria pode existir nos estados sólido, líquido e gasoso e mudanças de estado ocorrem com variações de temperatura.