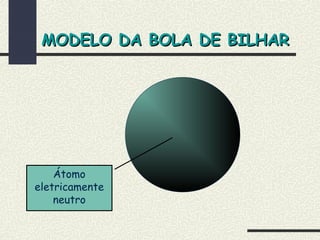
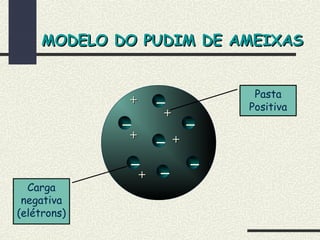
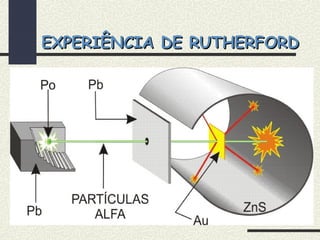
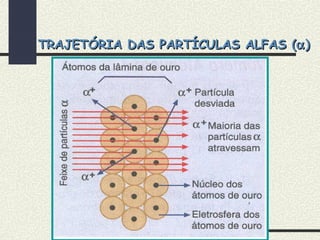
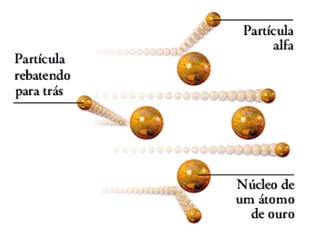
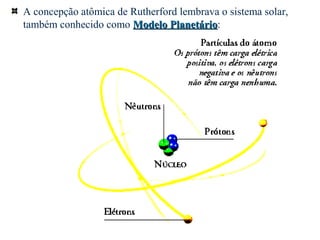
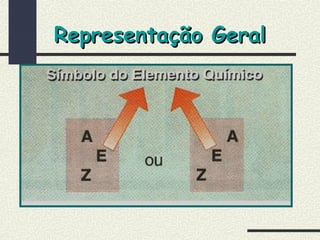
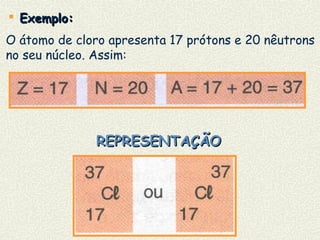
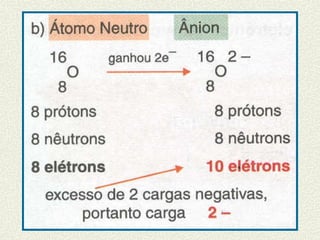
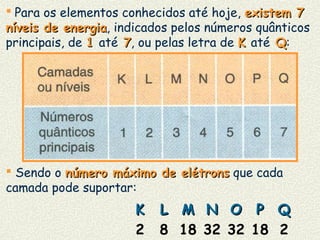
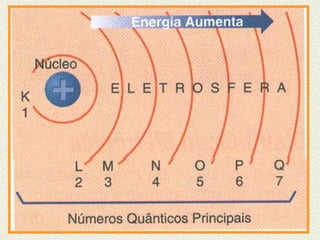
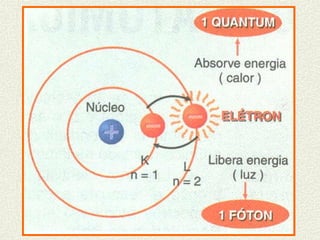
O documento descreve os principais modelos atômicos históricos, incluindo: 1) Modelo de Dalton, que via os átomos como esferas indivisíveis; 2) Modelo de Thomson, que propôs que os átomos eram feitos de elétrons embebidos em uma pasta positiva; 3) Modelo de Rutherford, que concluiu que os átomos têm um núcleo denso de carga positiva rodeado por elétrons.