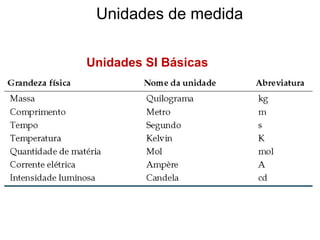
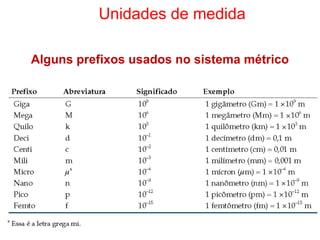
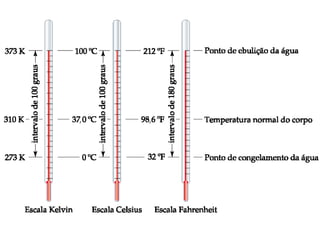
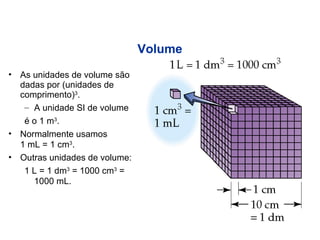
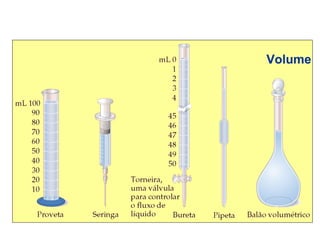
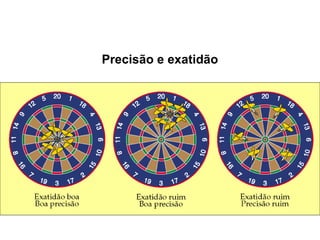
1) A química estuda a constituição da matéria, suas propriedades e transformações.
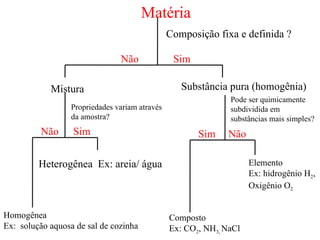
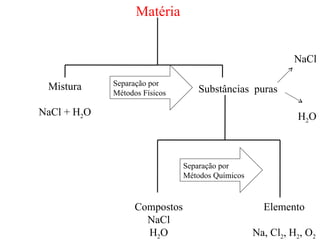
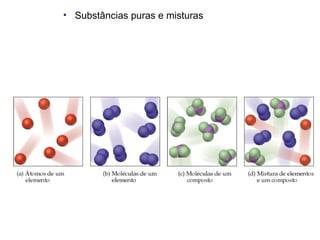
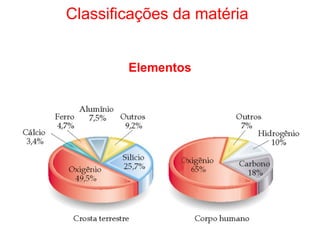
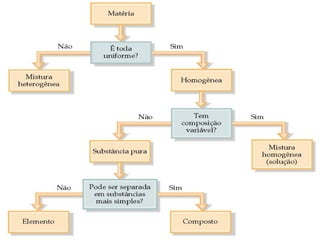
2) A matéria pode ser classificada como elementos, compostos ou misturas.
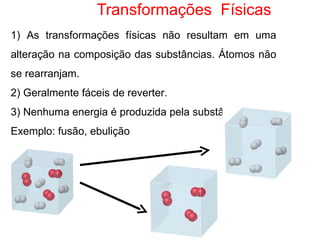
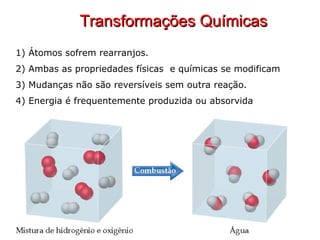
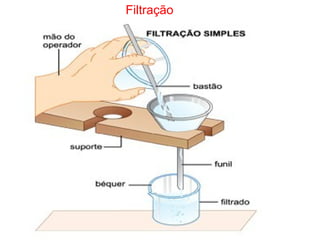
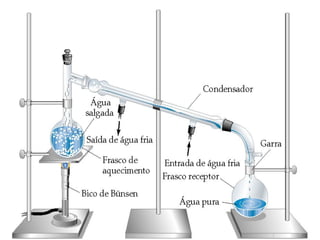
3) Transformações químicas envolvem rearranjos de átomos e mudanças nas propriedades, ao contrário de transformações físicas.