Incorporar apresentação
Baixar para ler offline




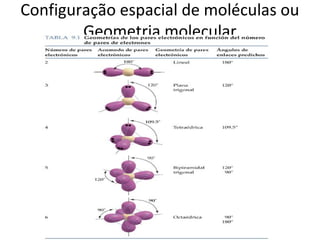
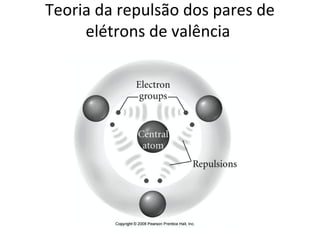
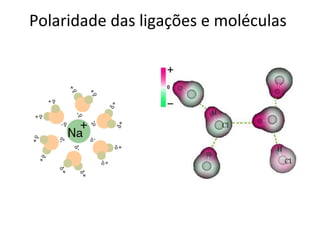
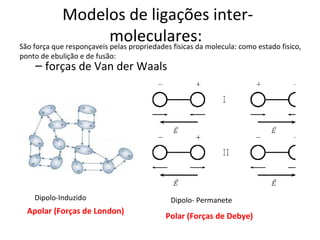





O documento discute os principais tipos de ligação química - iônica, covalente e metálica - e suas propriedades. Também aborda fórmulas químicas, geometria molecular, polaridade, solubilidade e cálculos estequiométricos.












