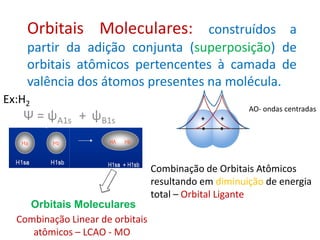
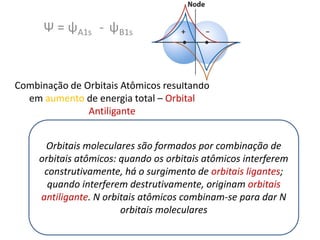
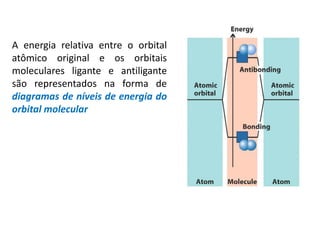
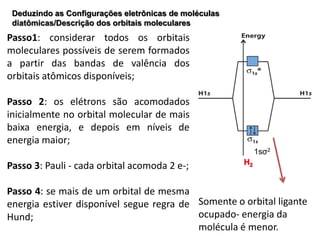
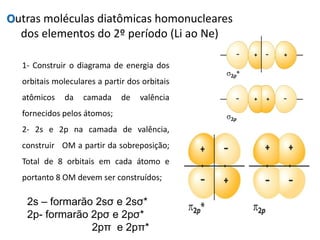
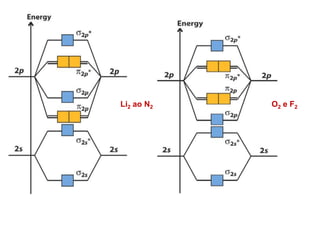
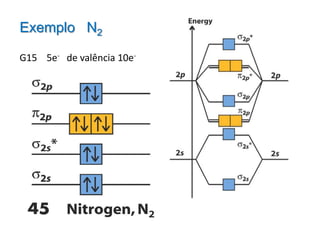
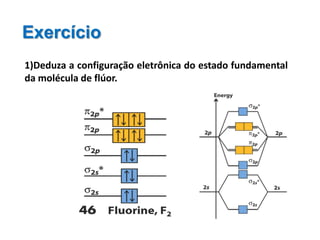
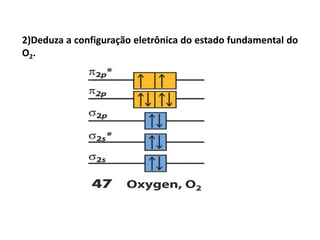
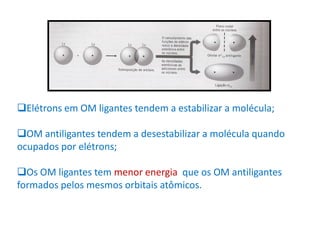
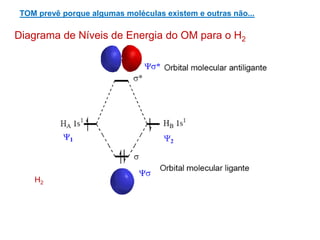
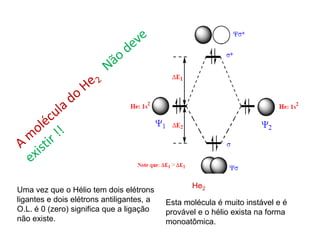
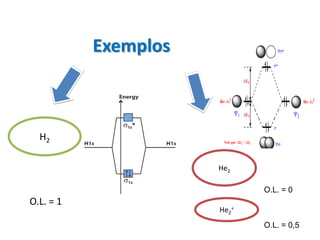
O documento apresenta os conceitos fundamentais da Teoria dos Orbitais Moleculares (TOM), incluindo a formação de orbitais moleculares a partir da combinação linear de orbitais atômicos, a distribuição eletrônica nos orbitais de acordo com as regras de Hund e Pauli, e a determinação da ordem de ligação química a partir da diferença entre o número de elétrons ligantes e antiligantes. Ilustra esses conceitos com exemplos como H2, He2, O2, F2 e íons.