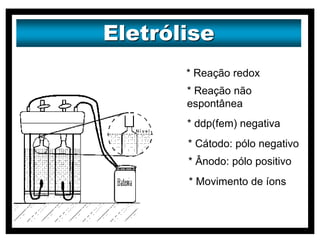
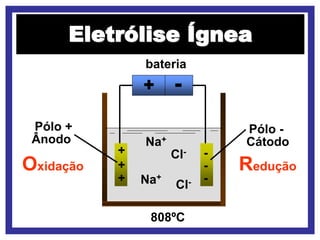
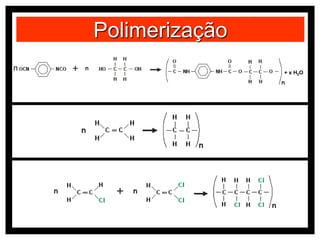
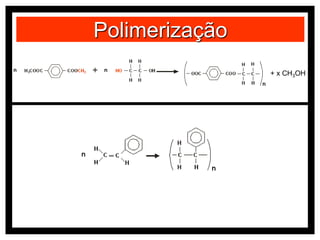
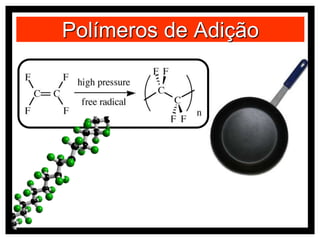
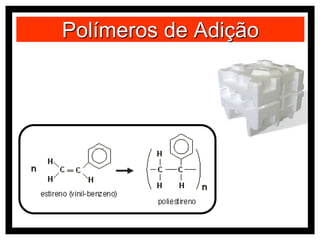
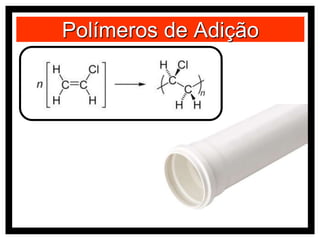
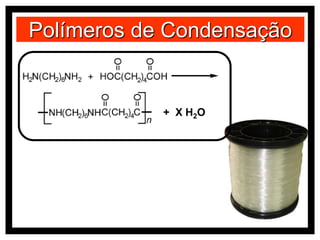
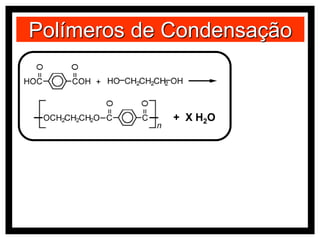
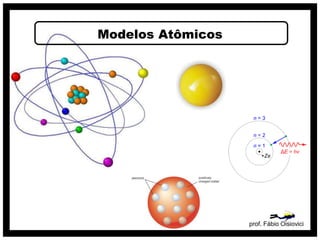
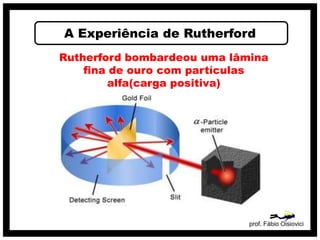
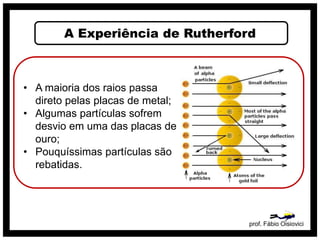
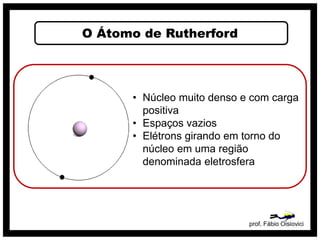
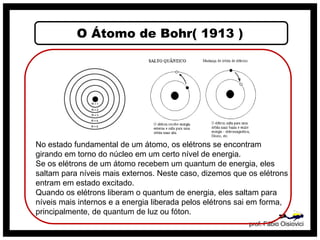
O documento discute vários modelos atômicos históricos, incluindo:
1) O modelo de Demócrito que propôs que a matéria é composta por átomos e espaços vazios.
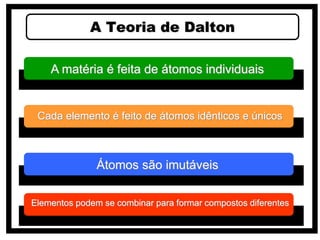
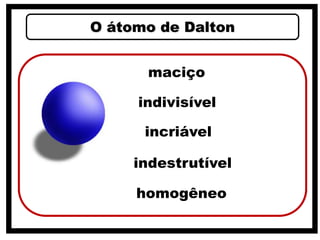
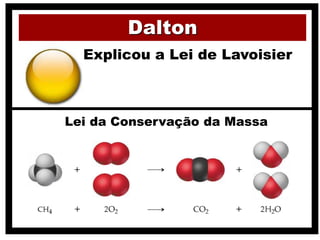
2) O modelo de Dalton que associou átomos à estequiometria e propôs que cada elemento é composto por átomos idênticos.
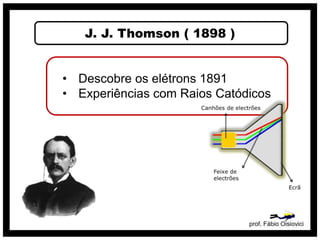
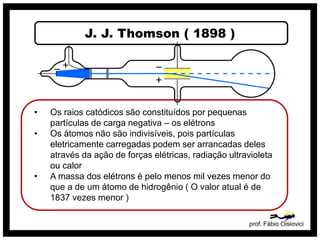
3) O modelo de Thomson que descobriu os elétrons e propôs que os átomos são constituídos por elétrons embebidos em uma massa positiva.