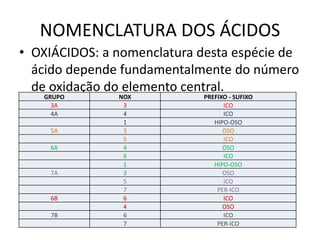
O documento discute as principais funções químicas, definindo-as como conjuntos de compostos que apresentam características físico-químicas similares. Detalha as teorias de ácidos, bases, sais e óxidos, além de apresentar suas classificações e nomenclaturas.