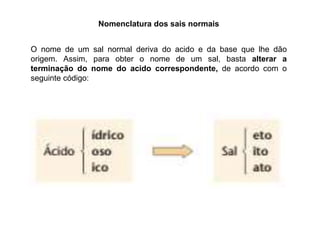
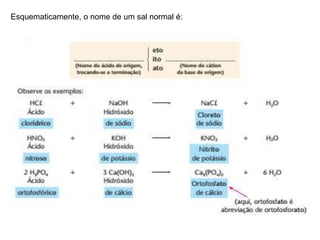
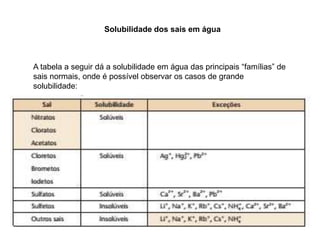
O documento discute diferentes tipos de sais, incluindo sua história, formação e usos. Sais são compostos formados pela reação de ácidos e bases, e são amplamente utilizados na alimentação, indústrias químicas e construção. O sal teve um papel importante em civilizações antigas e foi valioso o suficiente para ser usado como dinheiro. Diferentes tipos de sais incluem sais normais, ácidos, básicos, duplos e hidratados.