O documento discute os principais tópicos da eletroquímica, incluindo:
1) A definição de eletroquímica e suas aplicações principais como pilhas e eletrólise.
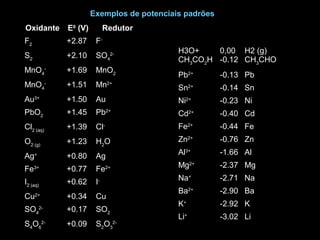
2) Leis e equações que regem processos eletroquímicos como a lei de Faraday, equação de Nernst e cálculo de potenciais de célula.
3) Exemplos históricos e aplicações industriais de pilhas e processos eletrolíticos.