Incorporar apresentação
Baixado 269 vezes


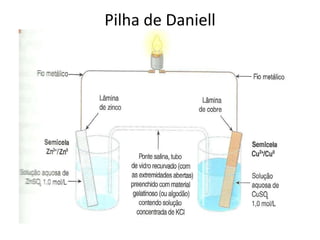

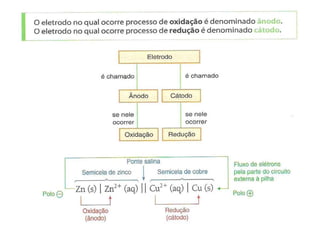
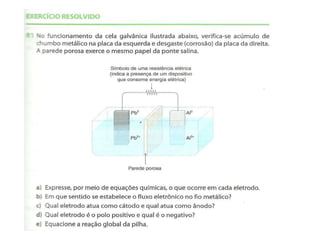



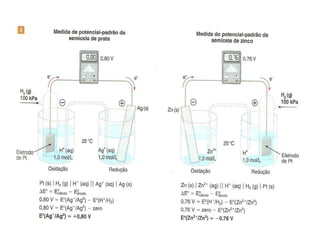









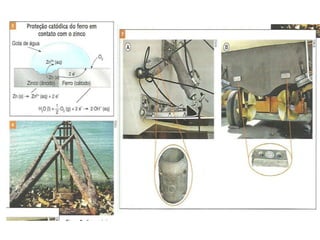


O documento descreve o funcionamento da pilha de Daniell, incluindo que o zinco é oxidado no ânodo enquanto o cobre é reduzido no cátodo, gerando uma corrente elétrica através da migração de elétrons do zinco para o cobre. A ponte salina equilibra as cargas transportando íons entre as semicelas.




















