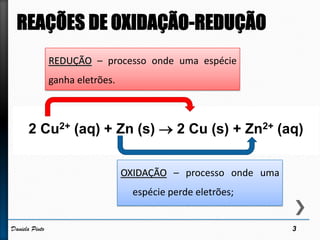
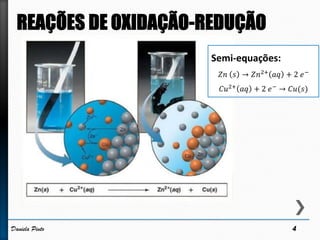
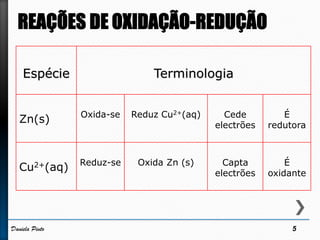
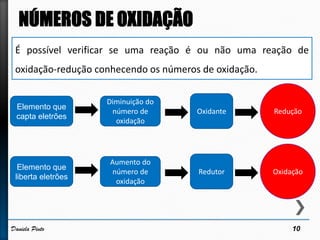
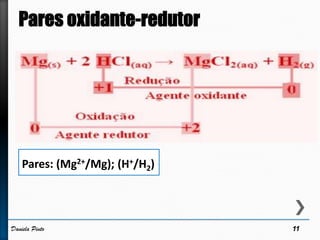
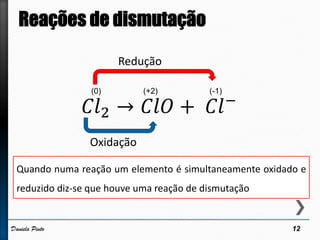
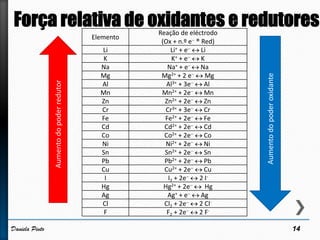
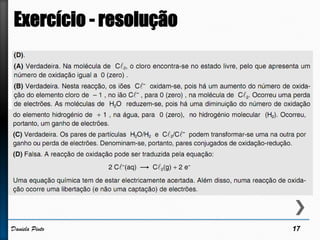
O documento discute reações redox, definindo oxidação como a perda de elétrons e redução como a ganho de elétrons. Ele apresenta um exemplo de reação redox entre Cu2+ e Zn, mostrando as semi-reações e identificando qual espécie é oxidada e qual é reduzida. Também discute números de oxidação e como eles podem ser usados para identificar se uma reação é redox.