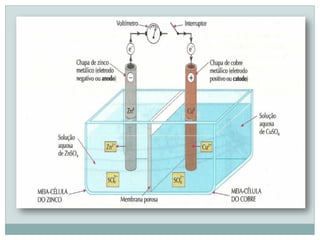
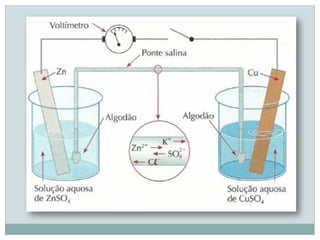
O documento discute eletroquímica, especificamente o funcionamento de pilhas elétricas. Ele explica que pilhas produzem corrente elétrica através de reações espontâneas de oxidação-redução que separam oxidantes e redutores. Também descreve a primeira pilha construída por Volta em 1800 usando discos de zinco e cobre separados por solução ácida, e a pilha aprimorada de Daniell em 1836 usando soluções salinas em vez de ácidas.