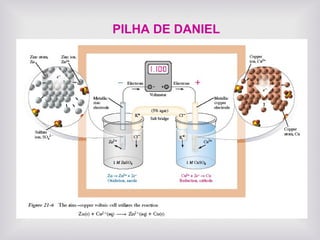
O documento discute a eletroquímica e sua nomenclatura, incluindo: (1) eletrodos transferem elétrons entre substâncias para converter energia química em elétrica; (2) ânodos são onde corrente entra na solução e cátodos onde sai; (3) células eletroquímicas conectam dois eletrodos através de um eletrólito e circuito externo.