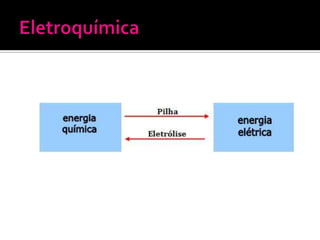
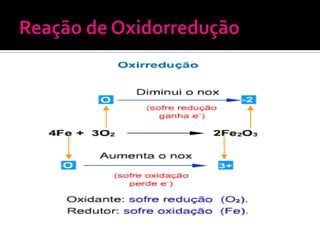
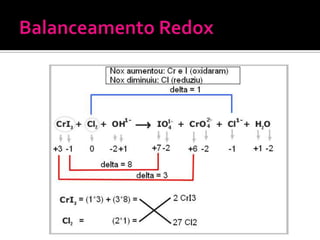
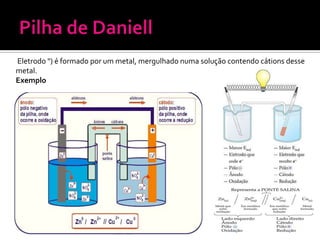
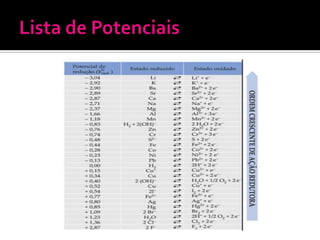
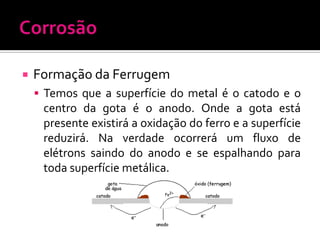
O documento descreve os principais conceitos de eletroquímica, incluindo: 1) oxidação e redução como transferência de elétrons entre oxidante e redutor; 2) potenciais de redução e oxidação e sua relação com a capacidade de sofrer redução ou oxidação; 3) pilhas eletroquímicas, células eletrolíticas e fatores que afetam a condução de corrente elétrica.