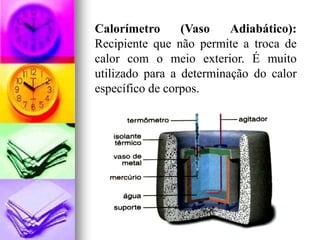
1) A calorimetria estuda a transferência de calor entre corpos e suas propriedades térmicas.
2) Quando dois corpos de temperaturas diferentes entram em contato, eles trocam calor até atingirem o equilíbrio térmico, quando possuem a mesma temperatura.
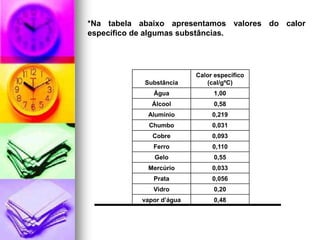
3) A capacidade térmica e o calor específico são propriedades que determinam a quantidade de calor necessária para alterar a temperatura de um corpo.