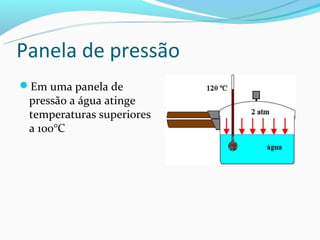
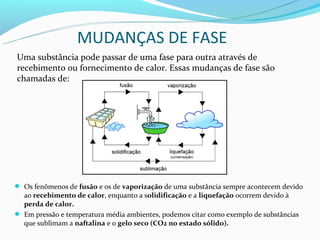
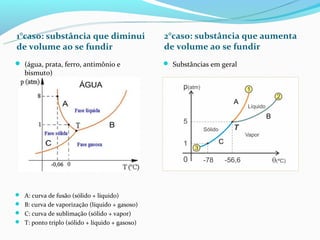
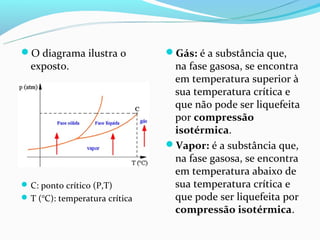
O documento discute as fases da matéria (sólida, líquida e gasosa), e como a temperatura e pressão afetam as mudanças de fase. É explicado que o aumento da temperatura causa o aumento do movimento molecular e a redução das forças de atração, levando à mudança de fase. A pressão também influencia os pontos de fusão e ebulição.